题目内容
进行Ba(OH)2溶液的导电实验时,如果向Ba(OH)2溶液中分别逐滴加入下列物质,能观察到灯光“亮→暗→灭→亮”变化的是
- A.NaOH溶液
- B.HCl溶液
- C.H2SO4溶液
- D.Na2CO3溶液
C
分析:水溶液要想导电必须具有自由移动的带电的微粒.带电的微粒越多越容易导电,再根据题意可知:溶液导电性越来越差,直至导电能力为零,到最后灯泡又发光,所以可以据此来分析溶液中离子的变化来完成解答.
解答:A、氢氧化钠和氢氧化钡不能反应,所以离子不会减少,所以灯光也不会变暗,故A不正确;
B、盐酸可以和氢氧化钡反应,但是由于生成了可溶性的氯化钡,所以灯泡不会灭,故B不正确;
C、硫酸可以和氢氧化钡反应生成沉淀和水,所以随着反应的进行溶液中的离子会越来越少,灯光越来越暗,至恰好完全反应时溶液中没有自由移动的离子,所以灯要灭,继续加入硫酸,则溶液中存在中氢离子和硫酸根离子,从而灯泡又会发光,故C正确;
D、碳酸钠可以和氢氧化钡反应生成沉淀,同时也生成了可溶性的氢氧化钠,所以灯泡不会灭,故D不正确.
故选C.
点评:熟练掌握物质的化学性质,并能够判断物质之间反应的产物,知道酸碱盐在水溶液中可以电离出可以自由移动的带电粒子.
分析:水溶液要想导电必须具有自由移动的带电的微粒.带电的微粒越多越容易导电,再根据题意可知:溶液导电性越来越差,直至导电能力为零,到最后灯泡又发光,所以可以据此来分析溶液中离子的变化来完成解答.
解答:A、氢氧化钠和氢氧化钡不能反应,所以离子不会减少,所以灯光也不会变暗,故A不正确;
B、盐酸可以和氢氧化钡反应,但是由于生成了可溶性的氯化钡,所以灯泡不会灭,故B不正确;
C、硫酸可以和氢氧化钡反应生成沉淀和水,所以随着反应的进行溶液中的离子会越来越少,灯光越来越暗,至恰好完全反应时溶液中没有自由移动的离子,所以灯要灭,继续加入硫酸,则溶液中存在中氢离子和硫酸根离子,从而灯泡又会发光,故C正确;
D、碳酸钠可以和氢氧化钡反应生成沉淀,同时也生成了可溶性的氢氧化钠,所以灯泡不会灭,故D不正确.
故选C.
点评:熟练掌握物质的化学性质,并能够判断物质之间反应的产物,知道酸碱盐在水溶液中可以电离出可以自由移动的带电粒子.

练习册系列答案
相关题目
学习了CO2的有关知识之后,同学们查阅资料发现Mg能在CO2中燃烧:2Mg+CO2
2MgO+C,所以镁着火不能用CO2来灭火.但没有找到有关钠能否与CO2反应的介绍.于是同学们展开钠着火能否用CO2来灭火的探究.
(一)【提出猜想】
钠能发生类似于CO2与镁的反应,可能的化学方程式为: .
(二)【实验】
将燃着的钠伸入装有CO2的集气瓶中,钠能在CO2中继续燃烧.
1、进一步查阅资料得知:
①Na2O是白色固体,能与CO2反应生成Na2CO3,与H2O反应生成NaOH.
②Ba(OH)2溶于水而BaCO3不溶于水.
③Na2CO3的存在会干扰NaOH的检测.
2、基于以上资料,同学们认为钠在CO2中燃烧的产物应该与Mg在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:
①Na2O、C ② 、C ③NaOH、C ④Na2O、Na2CO3、C
3、通过理论分析,猜想 (填序号)肯定是错误的,理由是: .
(三)【验证猜想】
1、在步骤(2)中BaCl2溶液为什么要加入至过量: .
2、在步骤(3)中也可以通过加入 试剂的方法进行检验(任写一种试剂).
(四)【结论】
猜想 (填序号)正确.
| ||
(一)【提出猜想】
钠能发生类似于CO2与镁的反应,可能的化学方程式为:
(二)【实验】
将燃着的钠伸入装有CO2的集气瓶中,钠能在CO2中继续燃烧.
1、进一步查阅资料得知:
①Na2O是白色固体,能与CO2反应生成Na2CO3,与H2O反应生成NaOH.
②Ba(OH)2溶于水而BaCO3不溶于水.
③Na2CO3的存在会干扰NaOH的检测.
2、基于以上资料,同学们认为钠在CO2中燃烧的产物应该与Mg在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:
①Na2O、C ②
3、通过理论分析,猜想
(三)【验证猜想】
| 步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
| (1) | 将产物溶于适量水中 | 部分溶解,试管 底部有黑色固体 |
燃烧产物中肯定有 |
| (2) | 取(1)所得少量上层清液,加入过量的BaCl2溶液 | 燃烧产物中肯定有Na2CO3 | |
| (3) | 取(2)所得少量上层清液,加入 |
有蓝色沉淀生成 | 燃烧产物中肯定有 |
2、在步骤(3)中也可以通过加入
(四)【结论】
猜想
学习了CO2的有关知识之后,同学们查阅资料发现Mg能在CO2中燃烧:2Mg+CO2 2MgO+C,所以镁着火不能用CO2来灭火.但没有找到有关钠能否与CO2反应的介绍.于是同学们展开钠着火能否用CO2来灭火的探究.
2MgO+C,所以镁着火不能用CO2来灭火.但没有找到有关钠能否与CO2反应的介绍.于是同学们展开钠着火能否用CO2来灭火的探究.
(一)【提出猜想】
钠能发生类似于CO2与镁的反应,可能的化学方程式为:______.
(二)【实验】
将燃着的钠伸入装有CO2的集气瓶中,钠能在CO2中继续燃烧.
1、进一步查阅资料得知:
①Na2O是白色固体,能与CO2反应生成Na2CO3,与H2O反应生成NaOH.
②Ba(OH)2溶于水而BaCO3不溶于水.
③Na2CO3的存在会干扰NaOH的检测.
2、基于以上资料,同学们认为钠在CO2中燃烧的产物应该与Mg在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:
①Na2O、C ②______、C ③NaOH、C ④Na2O、Na2CO3、C
3、通过理论分析,猜想______(填序号)肯定是错误的,理由是:______.
(三)【验证猜想】
| 步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
| (1) | 将产物溶于适量水中 | 部分溶解,试管 底部有黑色固体 | 燃烧产物中肯定有______ |
| (2) | 取(1)所得少量上层清液,加入过量的BaCl2溶液 | ______ | 燃烧产物中肯定有Na2CO3 |
| (3) | 取(2)所得少量上层清液,加入______溶液 | 有蓝色沉淀生成 | 燃烧产物中肯定有______ |
2、在步骤(3)中也可以通过加入______试剂的方法进行检验(任写一种试剂).
(四)【结论】
猜想______(填序号)正确.
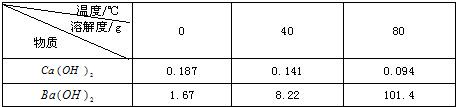

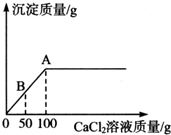 五一节后,小丽带着快乐的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望.
五一节后,小丽带着快乐的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望.