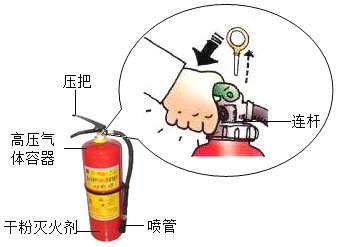
题目内容
【题目】(1)用化学用语填空:
①2个氢离子__________________;
②氮气________________;
③乙酸________________。
(2)工业上利用石墨制金刚石,要得到纯净的金刚石,常用高氯酸(HClO4)来清洗金刚石中混有的石墨,高氯酸和石墨在常温下反应生成三种物质:水、有毒的氯气(Cl2)和一种常见的无毒的气态化合物,写出上述反应的化学方程式____________________。
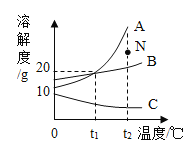
(3)下图为a、b、c三种固体物质的溶解度曲线。
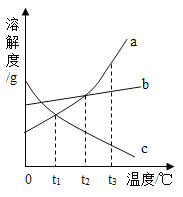
①t1℃时a、b、c的溶解度由小到大的顺序是___________。
②取t3℃时a、b、c的饱和溶液各100g分别降温至t1℃,此时三种溶液中含溶剂质量最多的是_________。
【答案】2H+ He CH3COOH ![]() a=c<b c
a=c<b c
【解析】
(1)①由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。若表示多个该离子,就在其离子符号前加上相应的数字,所以2个氢离子表示为2H+;
②氦气是单原子分子,可以用元素符号直接表示,所以氦气表示为He;
③乙酸的化学式为:CH3COOH;
(2)高氯酸和石墨在常温下反应生成三种物质:水、有毒的氯气(Cl2)和二氧化碳,化学方程式为:4HClO4+7C=2H2O+2Cl2↑+3CO2↑;
(3)①通过分析溶解度曲线可知,t1℃时a、b、c的溶解度由小到大的顺序是:a=c<b;
②t3℃时,c物质的溶解度最小,a、b、c的饱和溶液各100g,c溶液中的溶剂最多,所以分别降温至t1℃,不会影响溶剂的变化,此时三种溶液中含溶剂质量最多的是c。

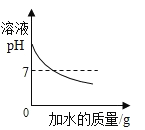
【题目】(1)用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程溶液pH变化曲线如图所示:
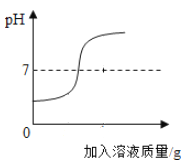
①该反应的化学方程式是_____;
②该实验操作是将_____(写溶质的化学式)溶液逐滴加入到另一种溶液中。
(2)若用稀硫酸代替(1)中的稀盐酸,将稀硫酸逐滴加入至盛有氢氧化钠溶液的烧杯中,当滴加到一定量并充分反应时,请对烧杯中溶质成分进行探究。
(提出问题)此时烧杯中的溶液成分是什么?
(猜想与假设)I:Na2SO4 II:_____ III:Na2SO4和NaOH
(实验与探究)
实验步骤 | 实验现象 | 实验结论 |
取少量上述烧杯中的溶液于试管中,滴加_____溶液 | _____ | 猜想III正确 |
【题目】金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)某实验小组为了探究锌与硫酸反应快慢的影响因素,进行了如下实验。
实验编号 | 硫酸的质量分数 (均取20 mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 30% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
①用如图装置收集并测量氢气的体积,其中量筒作用是_____________________,氢气应从_____(填e或f或g)管通入。

②要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是___________。
③下表是小兵第①组实验的详细数据。
时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应的快慢的变化_________________________________________。
解释原因_________________________________________________________。
(2)保险粉(化学式 Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4 在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在 NaCl 存在下,Na2S2O4 在水中溶解度显著下降。Na2S2O4 制备流程如下:

①已知反应Ⅰ的原理为:Zn + 2SO2 == ZnS2O4,反应Ⅱ为复分解反应,反应Ⅱ的化学方程式为______________________________________________。
②操作a的名称为_______________________。
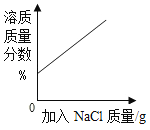
③滤液中含有 Na2S2O4,为使 Na2S2O4 结晶析出还需要加入少量 NaOH 的原因是__________________________, 加入NaCl的原因是_______________________。
④198gZn(OH)2理论上能得到Zn的质量为_____________。