题目内容
在天平的两边分别放了质量相等的烧杯,烧杯中各盛100g 9.8%的硫酸溶液,此时天平平衡,同时向左、右两烧杯中分别加入X、Y,指针先向左偏转,反应完毕后,指针偏右的一组选项是( )| 选 项 | A | B | C | D |
| X 的质量/g | 5g.Zn | 6g Fe | 7g Fe | 8gZn |
| Y 的质量/g | 5g Fe | 6gZn | 7gZn | 8g Fe |
A.A
B.B
C.C
D.D
【答案】分析:向左、右两烧杯中分别加入X、Y,指针先向左偏转,说明左边烧杯中质量多,右边烧杯中质量少,即右边烧杯中金属产生的氢气多,由于锌比铁活泼,与酸反应速度快,产生氢气多,所以左侧放的是铁,右侧放的是锌;反应完毕后,指针偏右的,说明最后还是铁产生的氢气多,锌产生的氢气少,说明铁和锌不能全部把酸反应完,否则天平会平衡.
解答:解:设把100g 9.8%的硫酸溶液反应完需要铁的质量为x则:
Fe+H2SO4 ═FeSO4 +H2↑
56 98
x 100g×9.8%
根据: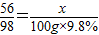 解得x=5.6g,
解得x=5.6g,
设把100g 9.8%的硫酸溶液反应完需要锌的质量为y则:
Zn+H2SO4 ═ZnSO4 +H2↑
65 98
y 100g×9.8%
根据: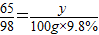 解得y=6.5g;
解得y=6.5g;
A、由于锌比铁活泼,反应速度快,反应在开始一段时间内,单位时间内锌产生的氢气比铁产生的氢气多,所以开始天平偏向铁的一边,所以左边烧杯内应放入铁,故A错;
B、由于锌比铁活泼,反应速度快,反应在开始一段时间内,单位时间内锌产生的氢气比铁产生的氢气多,所以开始天平偏向铁的一边,所以左边烧杯内应放入铁,由于铁是6g已经把硫酸反应完了,锌是6g,还没有把硫酸反应完,所以最后铁与硫酸反应产生的氢气多,锌与硫酸反应产生的氢气少,最后偏向锌的一边,即偏向右侧,故B正确;
C、铁和锌都把硫酸反应完了,所以生成氢气质量相等,即最后天平是平衡的,故C错;
D、由于锌比铁活泼,反应速度快,反应在开始一段时间内,单位时间内锌产生的氢气比铁产生的氢气多,所以开始天平偏向铁的一边,所以左边烧杯内应放入铁,且铁和锌都把硫酸反应完了,所以生成氢气质量相等,即最后天平是平衡的,故D错.
故选B.
点评:解答本题关键是要知道锌比铁活泼,反应速度快,开始锌产生氢气多,最后天平偏向右侧,说明最后铁产生的氢气要比锌产生的氢气多.
解答:解:设把100g 9.8%的硫酸溶液反应完需要铁的质量为x则:
Fe+H2SO4 ═FeSO4 +H2↑
56 98
x 100g×9.8%
根据:
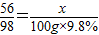 解得x=5.6g,
解得x=5.6g,设把100g 9.8%的硫酸溶液反应完需要锌的质量为y则:
Zn+H2SO4 ═ZnSO4 +H2↑
65 98
y 100g×9.8%
根据:
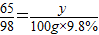 解得y=6.5g;
解得y=6.5g;A、由于锌比铁活泼,反应速度快,反应在开始一段时间内,单位时间内锌产生的氢气比铁产生的氢气多,所以开始天平偏向铁的一边,所以左边烧杯内应放入铁,故A错;
B、由于锌比铁活泼,反应速度快,反应在开始一段时间内,单位时间内锌产生的氢气比铁产生的氢气多,所以开始天平偏向铁的一边,所以左边烧杯内应放入铁,由于铁是6g已经把硫酸反应完了,锌是6g,还没有把硫酸反应完,所以最后铁与硫酸反应产生的氢气多,锌与硫酸反应产生的氢气少,最后偏向锌的一边,即偏向右侧,故B正确;
C、铁和锌都把硫酸反应完了,所以生成氢气质量相等,即最后天平是平衡的,故C错;
D、由于锌比铁活泼,反应速度快,反应在开始一段时间内,单位时间内锌产生的氢气比铁产生的氢气多,所以开始天平偏向铁的一边,所以左边烧杯内应放入铁,且铁和锌都把硫酸反应完了,所以生成氢气质量相等,即最后天平是平衡的,故D错.
故选B.
点评:解答本题关键是要知道锌比铁活泼,反应速度快,开始锌产生氢气多,最后天平偏向右侧,说明最后铁产生的氢气要比锌产生的氢气多.

练习册系列答案
相关题目
在天平的两边分别放了质量相等的烧杯,烧杯中各盛100g 9.8%的硫酸溶液,此时天平平衡,同时向左、右两烧杯中分别加入X、Y,指针先向左偏转,反应完毕后,指针偏右的一组选项是( )
|
在天平的两边分别放了质量相等的烧杯,烧杯中各盛100g9.8%的硫酸溶液,此时天平平衡,同时向左、右两烧杯中分别加入X、Y,指针先向左偏转,反应完毕后,指针偏右的一组选项是 ( )
| 选 项 | A | B | C | D |
| X 的质量/g | 5g.Zn | 6g Fe | 7gFe | 8g.Zn |
| Y 的质量/g | 5g Fe | 6g.Zn | 7g.Zn | 8g Fe |