题目内容
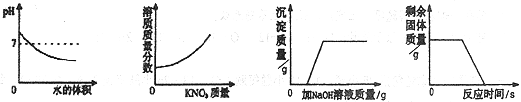
【题目】有一种石灰石样品的成分是CaCO3和SiO2。课外小组同学将100g盐酸分5次加入到35g该石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图像:
次数 | 第1次 | 第2次 | 第3次 |
加入盐酸的质量/g | 20 | 20 | 20 |
剩余固体的质量/g | 30 | a | 20 |
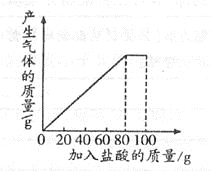
请计算:
(1)第2次加入盐酸后,a为 g;
(2)石灰石样品中碳酸钙的质量分数;(计算结果精确至0.1%)
(3)10%的CaCl2溶液可做路面保湿剂。欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)(计算结果精确至0.1g)
【答案】(1)25(2)57.1% (3)163.5g
【解析】
试题(1)没有加盐酸前,固体的质量为35g,第一次加入盐酸后,固体的质量减少了5g,即反应了5g碳酸钙,那么第2次加入盐酸后,又会反应5g碳酸钙,固体的质量变为25g,即a为25.
(2)根据图像分析,第4次加入盐酸后,样品中碳酸钙完全反应,此时剩余的固体SiO2质量为15g,则碳酸钙的质量为35g-15g=20g,。石灰石样品中碳酸钙的质量分数=20g/35g×100%=57.1%
(3)由图表可知,每消耗20g盐酸,会消耗5g CaCO3,则100g盐酸消耗25g CaCO3。
设100g盐酸完全反应后,溶液中CaCl2的质量为x,生成CO2的质量为y
CaCO3+ 2HCl === CaCl2 + H2O + CO2↑
100 111 44
25g x y
100/111 = 2g5/x x = 27.75g
100/44 = 25g/y y=11g
所得CaCl2溶液的质量为25g+100g-11g=114g
设还需要加水的质量为z
27.75g/(114g+z) ×100%=10%
z=163.5g
答:(1)a为25g;
(2)石灰石样品中碳酸钙的质量分数为57.1%;
(3)还需要向滤液中加入163.5g水。

 中考解读考点精练系列答案
中考解读考点精练系列答案