题目内容
通常状况下某NH4NO3晶体的样品中,测得其中氮元素的质量分数为38%,那么该样品所含的杂质在下列物质中可能是( )A.NH4Cl
B.N2
C.(NH4)2SO4
D.CO(NH2)2
【答案】分析:首先计算纯净物硝酸铵中氮元素的质量分数,然后与样品中氮的质量分数相比,看谁的高.若样品中的高,则杂质中氮的质量分数必定高于硝酸铵中的;若样品中的低,则杂质中氮的质量分数必然低于硝酸铵中的.
解答:解:纯净硝酸铵[NH4NO3]中氮元素的质量分数=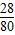 ×100%=35%
×100%=35%
A、NH4Cl中氮元素的质量分数=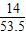 ×100%=22.1%
×100%=22.1%
B、氮气是气体,不可能存在于硝酸铵晶体中.
C、(NH4)2SO4中氮元素的质量分数=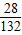 ×100%=21.2%
×100%=21.2%
D、CO(NH2)2中氮元素的质量分数= ×100%=46.7%;
×100%=46.7%;
样品中氮元素的质量分数为38%>35%,样品中含氮量高,则杂质中氮的质量分数必定高于硝酸铵中的;
故选D.
点评:本题是一道有关混合物组成判断的定量计算题,解答此类题的方法一般用极端假设法,采用平均值法进行比较.即混合物所计算的数值必须在各成分计算的数值的中间.如本题混合物的含氮量必须在硝酸铵和杂质的含氮量之间.
解答:解:纯净硝酸铵[NH4NO3]中氮元素的质量分数=
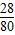 ×100%=35%
×100%=35%A、NH4Cl中氮元素的质量分数=
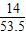 ×100%=22.1%
×100%=22.1%B、氮气是气体,不可能存在于硝酸铵晶体中.
C、(NH4)2SO4中氮元素的质量分数=
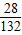 ×100%=21.2%
×100%=21.2%D、CO(NH2)2中氮元素的质量分数=
 ×100%=46.7%;
×100%=46.7%;样品中氮元素的质量分数为38%>35%,样品中含氮量高,则杂质中氮的质量分数必定高于硝酸铵中的;
故选D.
点评:本题是一道有关混合物组成判断的定量计算题,解答此类题的方法一般用极端假设法,采用平均值法进行比较.即混合物所计算的数值必须在各成分计算的数值的中间.如本题混合物的含氮量必须在硝酸铵和杂质的含氮量之间.

练习册系列答案
相关题目
通常状况下某NH4NO3晶体的样品中,测得其中氮元素的质量分数为38%,那么该样品所含的杂质在下列物质中可能是( )
| A、NH4Cl | B、N2 | C、(NH4)2SO4 | D、CO(NH2)2 |