题目内容
将43.5g硝酸钡溶液和21.2g碳酸钠溶液混合恰好完全反应,所得溶液的质量为54.85g.求:(1)生成碳酸钡沉淀的质量.
(2)反应前碳酸钠溶液中溶质的质量分数.
(3)反应后所得溶液中溶质的质量分数.
【答案】分析:硝酸钡与碳酸钠反应生成碳酸钡沉淀和硝酸钠,首先利用质量守恒定律,求得生成沉淀碳酸钡的质量;然后根据反应的化学方程式确定反应中各物质的质量关系,利用物质间的质量关系可由碳酸钡的质量计算参加反应碳酸钠的质量及生成硝酸钠的质量;从而求出反应前碳酸钠溶液中溶质的质量分数、反应后所得溶液中溶质的质量分数.
解答:解:根据质量守恒定律,生成碳酸钡沉淀的质量=43.5g+21.2g-54.85g=9.85g;
设碳酸钠的质量为x,生成硝酸钠的质量为y
Ba(NO3)2+Na2CO3═BaCO3↓+2NaNO3,
106 197 170
x 9.85g y
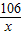 =
=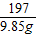 =
=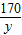
x=5.3g,y=8.5g
反应前碳酸钠溶液中溶质的质量分数=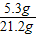 ×100%=25%
×100%=25%
反应后所得溶液中溶质的质量分数=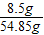 ×100%≈15.5%
×100%≈15.5%
答:(1)生成碳酸钡沉淀的质量为9.85g;(2)反应前碳酸钠溶液中溶质的质量分数为25%;(3)反应后所得溶液中溶质的质量分数为15.5%.
点评:利用质量守恒定律计算出反应产生碳酸钡沉淀的质量是解答本题的基础,也体现出分析问题的能力.
解答:解:根据质量守恒定律,生成碳酸钡沉淀的质量=43.5g+21.2g-54.85g=9.85g;
设碳酸钠的质量为x,生成硝酸钠的质量为y
Ba(NO3)2+Na2CO3═BaCO3↓+2NaNO3,
106 197 170
x 9.85g y
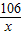 =
=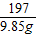 =
=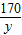
x=5.3g,y=8.5g
反应前碳酸钠溶液中溶质的质量分数=
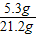 ×100%=25%
×100%=25%反应后所得溶液中溶质的质量分数=
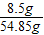 ×100%≈15.5%
×100%≈15.5%答:(1)生成碳酸钡沉淀的质量为9.85g;(2)反应前碳酸钠溶液中溶质的质量分数为25%;(3)反应后所得溶液中溶质的质量分数为15.5%.
点评:利用质量守恒定律计算出反应产生碳酸钡沉淀的质量是解答本题的基础,也体现出分析问题的能力.

练习册系列答案
相关题目