题目内容
质量相同的镁、铁、锌,分别放入溶质的质量分数均为10%的稀硫酸中,恰好完全反应.下列说法正确的是( )A.生成氢气的质量都相等
B.铁与稀硫酸反应后所得溶液的质量最大
C.与镁反应所需稀硫酸的质量最大
D.锌与稀硫酸反应后所得溶液中溶质的质量分数最大
【答案】分析:依据金属与酸反应时生成的氢气质量=金属的质量× 判断生成氢气的多少和消耗酸的多少,而生成的溶液溶质质量分数的大小则需要依据化学方程式进行计算;
判断生成氢气的多少和消耗酸的多少,而生成的溶液溶质质量分数的大小则需要依据化学方程式进行计算;
解答:解:依据金属与酸反应时生成的氢气质量=金属的质量× 可知,同质量的镁、铁、锌完全反应生成的氢气大小关系是镁>铁>锌,由于氢气实质上是来源与酸中的氢元素,故生成的氢气越多则消耗的酸越多,故可判断A错误,C正确;
可知,同质量的镁、铁、锌完全反应生成的氢气大小关系是镁>铁>锌,由于氢气实质上是来源与酸中的氢元素,故生成的氢气越多则消耗的酸越多,故可判断A错误,C正确;
假设三种金属的质量都是a设生成的氢气质量是x消耗硫酸的质量是y生成盐的质量是z
以镁为例计算:
Mg+H2SO4═MgSO4+H2↑
24 98 120 2
a y z x

则x= y=
y=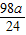 z=
z=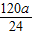
同理铁反应时x=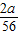 y=
y= z=
z= 锌反应时x=
锌反应时x=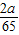 y=
y= z=
z= ;
;
所得溶液的质量为金属的质量+酸的质量-氢气的质量,比较以上数据可知镁反应后生成的溶液质量最大;
反应后溶液的溶质质量分数为 ,比较以上数据可得锌与稀硫酸反应后所得溶液中溶质的质量分数最大;
,比较以上数据可得锌与稀硫酸反应后所得溶液中溶质的质量分数最大;
故选CD
点评:此题是有关金属与酸反应的计算,解题的关键是能够利用相关的规律对数据进行分析比较;
 判断生成氢气的多少和消耗酸的多少,而生成的溶液溶质质量分数的大小则需要依据化学方程式进行计算;
判断生成氢气的多少和消耗酸的多少,而生成的溶液溶质质量分数的大小则需要依据化学方程式进行计算;解答:解:依据金属与酸反应时生成的氢气质量=金属的质量×
 可知,同质量的镁、铁、锌完全反应生成的氢气大小关系是镁>铁>锌,由于氢气实质上是来源与酸中的氢元素,故生成的氢气越多则消耗的酸越多,故可判断A错误,C正确;
可知,同质量的镁、铁、锌完全反应生成的氢气大小关系是镁>铁>锌,由于氢气实质上是来源与酸中的氢元素,故生成的氢气越多则消耗的酸越多,故可判断A错误,C正确;假设三种金属的质量都是a设生成的氢气质量是x消耗硫酸的质量是y生成盐的质量是z
以镁为例计算:
Mg+H2SO4═MgSO4+H2↑
24 98 120 2
a y z x

则x=
 y=
y=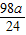 z=
z=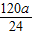
同理铁反应时x=
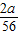 y=
y= z=
z= 锌反应时x=
锌反应时x=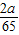 y=
y= z=
z= ;
;所得溶液的质量为金属的质量+酸的质量-氢气的质量,比较以上数据可知镁反应后生成的溶液质量最大;
反应后溶液的溶质质量分数为
 ,比较以上数据可得锌与稀硫酸反应后所得溶液中溶质的质量分数最大;
,比较以上数据可得锌与稀硫酸反应后所得溶液中溶质的质量分数最大;故选CD
点评:此题是有关金属与酸反应的计算,解题的关键是能够利用相关的规律对数据进行分析比较;

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目