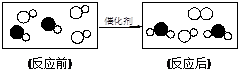
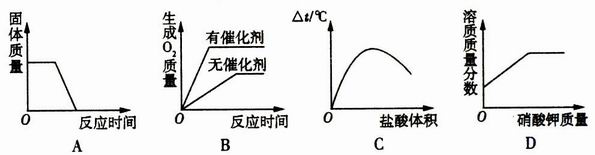
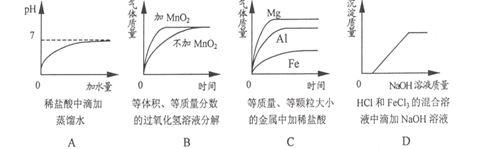
题目内容
H2、O2和N2组成的混合气体20g,经点燃充分反应后生成18g水,则剩余的气体不可能是( )
| A.N2和H2 | B.N2和O2 | C.N2 、H2和O2 | D.只有2gN2 |
C
析:根据H2、O2和N2三种物质的性质进行分析.H2、O2和N2的混合气体20克,点燃时,氢气和氧气完全反应生成了18g水,则剩余2g气体,由于氢气和氧气能反应,剩余的气体中不可能同时含有氢气和氧气.
解答:解:由题意可知,H2、O2和N2的混合气体20克,点燃时,氢气和氧气完全反应后生成18克水,则剩余2g气体,由于氢气和氧气能反应,所以剩余的气体中不可能同时含有氢气和氧气.由于在点燃时,氢气和氮气不反应,氧气和氮气不反应,所以剩余的气体中可能是氢气和氮气的混合气体,也有可能是氧气和氮气的混合气体,当混合气体中氢气和氧气恰好完全反应时,则剩余的2g气体就是氮气.所以,A、B、D有可能,C不可能.
故选C.
解答:解:由题意可知,H2、O2和N2的混合气体20克,点燃时,氢气和氧气完全反应后生成18克水,则剩余2g气体,由于氢气和氧气能反应,所以剩余的气体中不可能同时含有氢气和氧气.由于在点燃时,氢气和氮气不反应,氧气和氮气不反应,所以剩余的气体中可能是氢气和氮气的混合气体,也有可能是氧气和氮气的混合气体,当混合气体中氢气和氧气恰好完全反应时,则剩余的2g气体就是氮气.所以,A、B、D有可能,C不可能.
故选C.

练习册系列答案
相关题目
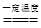 Cl2↑+2ClO2↑+2NaCl+2X,则X的化学式是
Cl2↑+2ClO2↑+2NaCl+2X,则X的化学式是