��Ŀ����
����Ŀ����ѧ������ѧϰ��ѧ����Ҫ���ߣ�
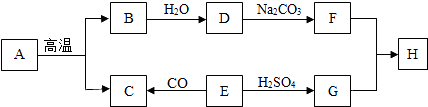
��1���û�ѧ������գ� �ٵ�ԭ����������������
������������������� �������к������Ľ���Ԫ��
��2������ĸ�����գ�a��Ca��OH��2 b��H2 c��C6H12O6 d��KMnO4�ٿ�����ʵ���������������� �ڿ����ڸ�����������������
�ۿ����������Դ������ ��ҽѧ�ϳ�Ϊ����Ѫ�ǡ��е�������
��3��д�����з�Ӧ�Ļ�ѧ����ʽ�� ���ռ��ڿ����б����� �ڵ��ˮ
�۹�ҵ����ԭ���� �ܼ�������غͶ������̵Ļ���� ��
���𰸡�
��1��I��3Fe3+��3SO3��Ca
��2��d��a��b��c
��3��2NaOH+CO2=Na2CO3+H2O��2H2O ![]() 2H2��+O2����3CO+Fe2O3
2H2��+O2����3CO+Fe2O3 ![]() 2Fe+3CO2��2KClO3
2Fe+3CO2��2KClO3 ![]() 2KCl+3O2��
2KCl+3O2��
���������⣺��1���ٸ���ԭ�ӵı�ʾ��������Ԫ�ط�������ʾһ��ԭ�ӣ���ʾ�����ԭ�ӣ�������Ԫ�ط���ǰ������Ӧ�����֣���˵�ԭ�ӱ�ʾΪ��I���ڸ������ӵı�ʾ�������ڱ�ʾ�����ӵ�Ԫ�ط������Ͻǣ���������������������������������ǰ�����������ں�1�����ʱ��1Ҫʡ�ԣ�����ʾ��������ӣ�������Ԫ�ط���ǰ������Ӧ�����֣�������������ӱ�ʾΪ��3Fe3+���۸��ݷ��ӵı�ʾ��������ȷ��д���ʵĻ�ѧʽ����ʾ����÷��ӣ������仯ѧʽǰ������Ӧ�����֣������������������ӱ�ʾΪ��3SO3���������к������Ľ���Ԫ���Ǹ�Ԫ�أ�����Ϊ��Ca����2���ٿ�����ʵ�������������Ǹ�����أ��ڿ����ڸ����������������������ƣ��ۿ����������Դ������������Ѫ���е���ͨ����ָ�����ǣ���3�����ռ��ڿ��������ױ��ʣ�����Ϊ���������еĶ�����̼��Ӧ����Ӧ�����������ƺͶ�����̼����������̼���ƺ�ˮ���ù۲취��ƽ�����Է���ʽ�ǣ�2NaOH+CO2=Na2CO3+H2O����ˮ��ͨ�����������������������������ʽΪ��2H2O ![]() 2H2��+O2�����۹�ҵ�ϵ�����ԭ������һ����̼��ԭ������������ʽΪ��3CO+Fe2O3
2H2��+O2�����۹�ҵ�ϵ�����ԭ������һ����̼��ԭ������������ʽΪ��3CO+Fe2O3 ![]() 2Fe+3CO2 ��������ڶ������̵Ĵ������������Ȼ��غ���������Ӧ�Ļ�ѧ����ʽΪ��2KClO3
2Fe+3CO2 ��������ڶ������̵Ĵ������������Ȼ��غ���������Ӧ�Ļ�ѧ����ʽΪ��2KClO3![]() 2KCl+3O2���� �𰸣���1����I����3Fe3+����3SO3����Ca����2����d����a����b����c����3����2NaOH+CO2=Na2CO3+H2O����2H2O
2KCl+3O2���� �𰸣���1����I����3Fe3+����3SO3����Ca����2����d����a����b����c����3����2NaOH+CO2=Na2CO3+H2O����2H2O ![]() 2H2��+O2������3CO+Fe2O3
2H2��+O2������3CO+Fe2O3 ![]() 2Fe+3CO2 ��2KClO3
2Fe+3CO2 ��2KClO3![]() 2KCl+3O2����
2KCl+3O2����
�����㾫����������Ҫ��������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ����������;�����ܵ���ȱ������֪ʶ�㣬��Ҫ����ע�⣺a����ƽ b������ c�����ţ�����������Ϊ����Դ�����������ŵ㣺����Ⱦ���������ߡ���Դ�������ȷ�����⣮

����Ŀ����ʽ̼��þ�����ֽܷ⣬������þ���Ʊ�����ҩ��ҵ�ȣ������һ����xMgCO3yMg��OH��2zH2O��ʾ�� 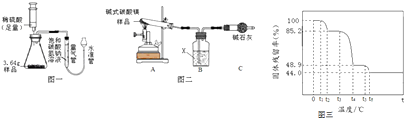
��1���о���ֽ���� ��i��ȡ���������գ����ж�����̼��ˮ���ɣ���ַ�Ӧ�õ���ɫ���壬�ɴ��ƶ��������п϶���������þ������̼�������� ��
��ii���������������Ƿ���̼��þ��������þ��
�������� | ���� | |
�� | ȡ���������������Թ��У� �� | �������в���̼��þ�� |
�� | ȡ���������������Թ��У�������ˮ�������̪��Һ���۲쵽���� | �������в���������þ�� |
��iii���÷�̪��Һ�����Ƿ����������þ��������ˮ������ˮ����Ϊ �� �ۺ�����ʵ���ƶϼ�ʽ̼��þ�ķֽ����Ϊ������̼��ˮ�� ��
��2���ⶨ��ʽ̼��þ��̼Ԫ�ص��������� ��ͼһ����ʵ�飮
����������װ�б���̼��������Һ��������ˮ��������Ϊ �� ����ϡ�������ϡ���ᣬ����̼Ԫ�ص��������������ƫ����ƫС������Ӱ�족����
��ʵ���й�����ϡ����20mL������������������������������Ϊ1.32g������������ܵ��������Ϊ �� ̼Ԫ�ص���������Ϊ �� ��ʵ��������CO2�ܶ�Ϊ1.97g/L��
��3��ȷ����ʽ̼��þ����� �����ͼ��װ�ã������������������
����1�����װ�õ������ԣ���36.4g��Ʒ�����Թ��У�����װ��B������Ϊ192g��
����2������װ��Aֱ����Ʒ��ȫ��Ӧ��
����3����ֹˮ�мн�װ��A��װ��B�佺Ƥ�ܣ�ֹͣ���ȣ���ȴ�����£�
����4������װ��B������Ϊ199.2g��
��i��װ��B������Ϊ �� װ��C������Ϊ �� �ж���Ʒ��ȫ��Ӧ�ķ��������۲쵽װ��B�� �� ����Ʒ����ȫ��Ӧ��
��4����ii����������ʵ�����������ʽ̼��þ�Ļ�ѧʽ��д��������̣�
��5������˵�����ȼ�ʽ̼��þ���ι���������������Ϊ���ɶ�����̼��������� ��ȡһ������ʽ̼��þ��Ʒ�ڿ����м��ȣ������Ʒ�Ĺ�������ʣ� ![]() ��100%�����¶ȵı仯��ͼ����ʾ����ش��������⣮
��100%�����¶ȵı仯��ͼ����ʾ����ش��������⣮
��0��t1�����й����������ֲ����ԭ���� ��
�ڷ���ͼ�������ж���˵���������ġ��ٵġ������ж�������