题目内容
【题目】等质量的X、Y两种金属分别与足量的同体积、同浓度的盐酸反应,产生气体的质量与时间的关系如图所示。下列说法中不正确的是( )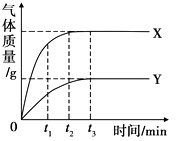
A.t1时,产生气体的质量:X>Y
B.t2时,消耗金属的质量:X>Y
C.t3时,消耗金属的质量:X=Y
D.t3时,消耗盐酸的质量:X=Y
【答案】D
【解析】A、t1时,产生气体的质量是X>Y,正确;A不符合题意;
B、由图可知,t2时,X已经消耗完,Y还没有消耗完,开始时两者的质量相等且酸是过量的,所以t2时消耗金属的质量X>Y,正确;B不符合题意;
C、由题干可知,金属的质量相等,且酸是足量的,所以最后金属全部反应完,图示中t3时刻两者的气体质量不再变化,说明金属已经完全反应,又金属的质量相等,所以消耗金属的质量X=Y,正确;C不符合题意;
D、t3时,产生气体的质量是X>Y,所以消耗盐酸的质量应该是X>Y,错误。D符合题意;
故答案为:D。金属与酸的反应曲线的特点:(1)线越陡,金属与酸反应越激烈,金属的活动性越强。(2)线越高,产生的氢气越多。(3)等质量的几种金属与足量的酸反应:生成氢气的质量与金属的化合价成正比;与金属的相对原子质量成反比。(4)等质量的几种金属与质量浓度均相等的酸反应,若生成氢气的质量相同,则金属化合价与相对原子质子质量的比值较大的金属一定过量,比值较小的金属可能过量也可能正好完全反应,酸一定反应完了。

练习册系列答案
相关题目