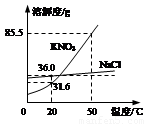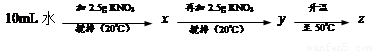题目内容
(6分)右下图为NaCl、KNO3的溶解度曲线(水的密度约为1g·cm-3)。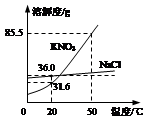
⑴20℃时,KNO3的溶解度是 g,以下实验中: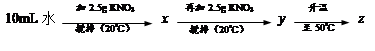
x、y、z中为饱和溶液的是 。
⑵若使NaCl溶液由不饱和变为饱和溶液,一般采用的方法
是 或 。
⑶除去KNO3固体中混有的少量NaCl,提纯的步骤是:加水溶解、 、 ,然后过滤、洗涤、干燥。
(1)31.6g y (2)蒸发溶剂至饱和 加NaCl固体至不再溶解
(3)蒸发浓缩 降温结晶(或冷却结晶)
解析试题分析:(1)根据溶解度曲线可知,20℃时,KNO3的溶解度是31.6g,即在20℃时,在100g水中,最多溶解硝酸钾31.6g而达到饱和状态,所以10mL水(相当于10g)中最多溶解3.16g溶质;故第一次加入2.5g硝酸钾后,没有达到饱和;再加入2.5g,即变成了5g,所以溶液已经饱和,且没有全部溶解;当升温到50℃时,硝酸钾的溶解度变为85.5g,即每10g水中最多能溶解8.55g硝酸钾;故升温后溶液变为不饱和溶液,故饱和溶液只有y。
(2)根据溶解度曲线可知,NaCl的溶解度受温度影响不大,故要使NaCl溶液由不饱和变为饱和溶液可以蒸发溶剂,也可以增加溶质。
(3)根据溶解度曲线可知:氯化钠的溶解度随温度的升高而逐渐增大,但受温度的变化影响较小;而硝酸钾的溶解度随温度的升高而逐渐增大,且变化较大;所以从含有少量氯化钠的硝酸钾饱和溶液中得到较多的硝酸钾晶体,可以采取冷却热饱和溶液的方法,即先加水溶解,加热制成热的饱和溶液,再进行降温结晶,然后过滤、洗涤、干燥,就可以得到硝酸钾。
考点:固体溶解度曲线及其作用
点评:本题主要考查了固体溶解度曲线所表示的意义,及根据固体溶解度曲线来解决相关问题,注重培养学生的分析问题、解决问题的能力,解题的关键是要熟记和理解固体溶解度曲线及其应用。

右下图为NaCl、KNO3的溶解度曲线(水的密度约为1g·cm-3)。
⑴20℃时,KNO3的溶解度是 ▲ g,以下实验中:
 |
x、y、z中为饱和溶液的是 ▲ 。
⑵若使NaCl溶液由不饱和变为饱和溶液,一般采用的方法是 ▲ 或 ▲ 。
⑶除去KNO3固体中混有的少量NaCl,提纯的步骤是:加水溶解、 ▲ 、 ▲ ,然后过滤、洗涤、干燥。
右下图为NaCl、KNO3的溶解度曲线(水的密度约为1g·cm-3)。
⑴20℃时,KNO3的溶解度是 ▲ g,以下实验中:
 |
x、y、z中为饱和溶液的是 ▲ 。
⑵若使NaCl溶液由不饱和变为饱和溶液,一般采用的方法是 ▲ 或 ▲ 。
⑶除去KNO3固体中混有的少量NaCl,提纯的步骤是:加水溶解、 ▲ 、 ▲ ,然后过滤、洗涤、干燥。
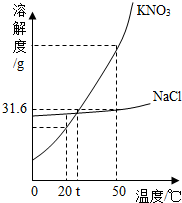 (2013?龙岩)右图为NaCl、KNO3的溶解度曲线,下列说法正确的是( )
(2013?龙岩)右图为NaCl、KNO3的溶解度曲线,下列说法正确的是( )