题目内容
 (2007?湘潭)在我国某地区有一种“冬天捞碱,夏天晒盐”的说法.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中含有少量的NaCl.
(2007?湘潭)在我国某地区有一种“冬天捞碱,夏天晒盐”的说法.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中含有少量的NaCl.某化学课外活动小组为了解释捞碱.晒盐的原理和测定“碱”样品中Na2CO3的含量进行了以下探究
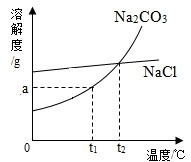
【查阅资料】Na2CO3和NaCl的溶解度曲线如图所示.
(1)根据如图所示回答:
①t1℃时Na2CO3的溶解度为
a
a
g;t2℃时Na2CO3的溶解度=
=
(填“<”“>”或“=”)NaCl的溶解度.
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而
减小
减小
(填“增大”“减小”或“不变”).③“夏天晒盐”是利用
A
A
(填序号)的方法,使NaCl晶体析出.A.风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
【实验步骤】
第一步:称取34.6g“碱”样品
第二步:将样品放入130g稀盐酸中,固体全部溶解,恰好完全反应.其化学方程式为:
Na2CO3+2HCl═2NaCl+H2O+CO2↑
第三步:完全反应后,称得溶液的总质量为151.4g.
【数据分析】
(2)若产生二氧化碳气体的全部逸出,试计算:(结果保留一位小数)
①产生二氧化碳气体的质量
②34.6g“碱”样品中碳酸钠的质量.
③“碱”样品中碳酸钠的质量分数.
[继续研究】
(3)计算反应后所得溶液中氯化钠的质量分数.
分析:[查阅资料]根据溶解度曲线的意义及溶解度受温度变化的影响来完成该部分①②③小题的解答;
根据题给的条件可以知道所发生的反应为碳酸钠和盐酸的反应,该反应生成了二氧化碳,反应中溶液质量减少的量即为二氧化碳气体的质量,所以可以根据二氧化碳气体的质量结合碳酸钠和盐酸的反应来完成[数据分析]和[继续研究]部分.
根据题给的条件可以知道所发生的反应为碳酸钠和盐酸的反应,该反应生成了二氧化碳,反应中溶液质量减少的量即为二氧化碳气体的质量,所以可以根据二氧化碳气体的质量结合碳酸钠和盐酸的反应来完成[数据分析]和[继续研究]部分.
解答:解:[查阅资料]①从溶解度曲线可以得出t1℃时Na2CO3的溶解度为ag;t2℃时Na2CO3的溶解度与NaCl的溶解度相等;
②从溶解度曲线可以得出碳酸钠的溶解度随温度的升高而增大,随温度降低而减小;
③氯化钠的溶解度受温度变化影响不大,应该通过蒸发的方法得到氯化钠晶体,而夏天温度较高,蒸发较快,故选A;
[数据分析]根据题意可以知道生成二氧化碳气体的质量为:34.6g+130g-151.4g=13.2g,故可以据此求出生成的氯化钠及混合物中碳酸钠的质量;
设34.6g“碱”样品中碳酸钠的质量为x,生成氯化钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 13.2g
=
=
解得:x=31.8g y=35.1g
所以碳酸钠的质量分数为:
×100%=91.9%;
答:①产生二氧化碳气体的质量为13.2g;
②34.6g“碱”样品中碳酸钠的质量为31.8g;
③“碱”样品中碳酸钠的质量分数91.9%;
[继续研究]
所以氯化钠的质量为:34.6g-31.8g+35.1g=37.9g
所以反应后所得溶液中氯化钠的质量分数:
×100%=25%;
答:反应后所得溶液中氯化钠的质量分数为25%.
故答案为:[查阅资料]①a;=;
②减小;
③A;
[数据分析]①13.2 g;
②31.8;
③91.9%;
[继续研究](3)25%
②从溶解度曲线可以得出碳酸钠的溶解度随温度的升高而增大,随温度降低而减小;
③氯化钠的溶解度受温度变化影响不大,应该通过蒸发的方法得到氯化钠晶体,而夏天温度较高,蒸发较快,故选A;
[数据分析]根据题意可以知道生成二氧化碳气体的质量为:34.6g+130g-151.4g=13.2g,故可以据此求出生成的氯化钠及混合物中碳酸钠的质量;
设34.6g“碱”样品中碳酸钠的质量为x,生成氯化钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 13.2g
| 106 |
| x |
| 117 |
| y |
| 44 |
| 13.2g |
解得:x=31.8g y=35.1g
所以碳酸钠的质量分数为:
| 31.8g |
| 34.6g |
答:①产生二氧化碳气体的质量为13.2g;
②34.6g“碱”样品中碳酸钠的质量为31.8g;
③“碱”样品中碳酸钠的质量分数91.9%;
[继续研究]
所以氯化钠的质量为:34.6g-31.8g+35.1g=37.9g
所以反应后所得溶液中氯化钠的质量分数:
| 37.9g |
| 151.4g |
答:反应后所得溶液中氯化钠的质量分数为25%.
故答案为:[查阅资料]①a;=;
②减小;
③A;
[数据分析]①13.2 g;
②31.8;
③91.9%;
[继续研究](3)25%
点评:熟练掌握溶解度曲线的意义,能够熟练的运用质量守恒定律以及化依据学方程式进行的相关计算.

练习册系列答案
相关题目