题目内容
将相同质量的铁、镁、锌、铝四种金属分别与足量的盐酸完全反应后,生成H2的质量由多到少的顺序是:______.
Mg的相对原子质量为24,24g镁可反应生成2g氢气,即1g镁生成
克氢气.
Al的相对原子质量为27,27g铝可反应生成3g氢气,即1g铝生成
克氢气.
Zn的相对原子质量为65,65g锌可反应生成2g氢气,即1g锌生成
克氢气.
铁的相对原子质量56,56g铁可反应生成2g氢气,即1g铁生成
g氢气.
故答案为:铝>镁>铁>锌
| 1 |
| 12 |
Al的相对原子质量为27,27g铝可反应生成3g氢气,即1g铝生成
| 1 |
| 9 |
Zn的相对原子质量为65,65g锌可反应生成2g氢气,即1g锌生成
| 1 |
| 32.5 |
铁的相对原子质量56,56g铁可反应生成2g氢气,即1g铁生成
| 1 |
| 28 |
故答案为:铝>镁>铁>锌

练习册系列答案
相关题目
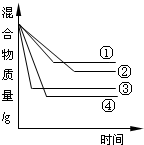 将相同质量的铁、锌、镁、铝分别加入到盛有足量盐酸的烧杯中,使其充分反应,烧杯中混合物的质量与反应时间的关系如图所示,图中曲线①②③④对应的金属依次是( )
将相同质量的铁、锌、镁、铝分别加入到盛有足量盐酸的烧杯中,使其充分反应,烧杯中混合物的质量与反应时间的关系如图所示,图中曲线①②③④对应的金属依次是( )