题目内容
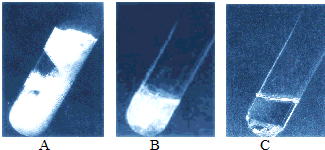
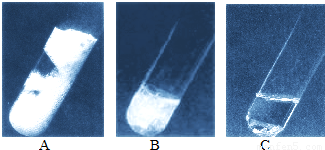
11、生活中的部分金属能与稀盐酸、稀硫酸等发生反应,但反应的难易和剧烈程度不同.如图是将溶质质量分数相同的稀盐酸分别加入三种金属时的现象.请根据现象回答下列问题.

(1)A、B、C三种金属的活动性由强到弱的顺序是
(2)写出一个活泼金属与稀盐酸或稀硫酸发生反应的化学方程式
(3)小明将一定量的溶质质量分数相同的稀盐酸分别加入镁、锌、铁三种金属中,充分反应后,生成氢气的质量相同.其原因可能是
A.金属的质量相同,稀盐酸足量
B.镁、锌、铁的质量比为24:65:56,稀盐酸足量
C.向镁、锌、铁中加入稀盐酸的质量比为2:3:2,三种金属足量
D.稀盐酸的质量相同,三种金属足量.

(1)A、B、C三种金属的活动性由强到弱的顺序是
A>B>C
.(2)写出一个活泼金属与稀盐酸或稀硫酸发生反应的化学方程式
Mg+2HCl═MgCl2+H2↑
,该反应的基本类型是置换反应
.(3)小明将一定量的溶质质量分数相同的稀盐酸分别加入镁、锌、铁三种金属中,充分反应后,生成氢气的质量相同.其原因可能是
A.金属的质量相同,稀盐酸足量
B.镁、锌、铁的质量比为24:65:56,稀盐酸足量
C.向镁、锌、铁中加入稀盐酸的质量比为2:3:2,三种金属足量
D.稀盐酸的质量相同,三种金属足量.
分析:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,金属的位置越靠前,反应的速度越快,根据金属与酸反应的质量关系即可求得生成氢气的质量相同时的可能性.
解答:解:(1)根据图示可以看出,A中产生气泡的速度最快,B中产生气泡的速度较慢,C中产生气泡的速度最慢,所以其活动性顺序为A>B>C,所以本题答案为:A>B>C;
(2)镁能与盐酸反应生成氯化镁和氢气,属于置换反应,所以本题答案为:Mg+2HCl═MgCl2+H2↑,置换反应;
(3)Mg+2HCl═MgCl2+H2↑
24 36.5 2
Fe+2HCl═FeCl2+H2↑
56 36.5 2
Zn+2HCl═ZnCl2+H2↑
65 36.5 2
根据反应的化学方程式可以看出,生成相同质量的氢气,①盐酸足量,镁、锌、铁的质量比为24:65:56,②当金属足量时,酸的质量相等,观察选项,故选BD.
(2)镁能与盐酸反应生成氯化镁和氢气,属于置换反应,所以本题答案为:Mg+2HCl═MgCl2+H2↑,置换反应;
(3)Mg+2HCl═MgCl2+H2↑
24 36.5 2
Fe+2HCl═FeCl2+H2↑
56 36.5 2
Zn+2HCl═ZnCl2+H2↑
65 36.5 2
根据反应的化学方程式可以看出,生成相同质量的氢气,①盐酸足量,镁、锌、铁的质量比为24:65:56,②当金属足量时,酸的质量相等,观察选项,故选BD.
点评:本题考查了金属活动性顺序的应用以及根据化学方程式的计算,完成此题,可以依据金属活动性顺序的意义进行,进行方程式的计算时,要找准物质之间的质量关系.

练习册系列答案
相关题目