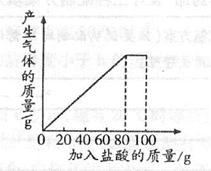
题目内容
将117.0g氯化钠溶液与140.0g的硝酸银溶液混合,恰好完全反应,过滤后所得溶液的质量为228.3g。计算该氯化钠溶液的溶质质量分数?
(反应的化学方程式为NaCl+AgNO3=AgCl↓+NaNO3)
(反应的化学方程式为NaCl+AgNO3=AgCl↓+NaNO3)
解:根据质量守恒定律,生成AgCl的质量为117.0g+140.0g-228.3g=28.7g……(1分)
设原溶液中氯化钠的质量为x
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
X 28.7 g
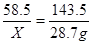 ……(1分)
……(1分)
x="11.7g" …………(1分)
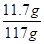 ×100%=10.0%…………(1分)
×100%=10.0%…………(1分)
答:氯化钠溶液的溶质质量分数是10.0% .
设原溶液中氯化钠的质量为x
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
X 28.7 g
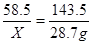 ……(1分)
……(1分)x="11.7g" …………(1分)
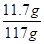 ×100%=10.0%…………(1分)
×100%=10.0%…………(1分)答:氯化钠溶液的溶质质量分数是10.0% .
试题分析:根据过滤后所得溶液的质量可以计算氯化银沉淀的质量,根据氯化银的质量利用化学方程式可以计算氯化钠的质量,进一步可以计算该氯化钠溶液的溶质质量分数.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目