题目内容
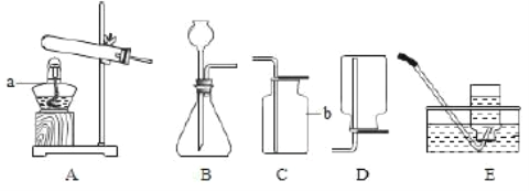
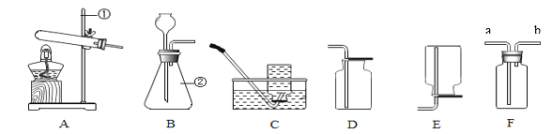
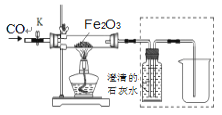
【题目】实验室按如图所示装置制取二氧化碳,并验证二氧化碳的性质,试回答以下问题。
(1)实验室制取二氧化碳的原理(用化学方程式表示)_______________。
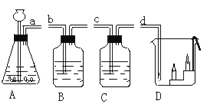
(2)将a和b的导管口连接时,可检验生成的二氧化碳气体 ,则在B中看到的实验现象是_________,化学反应方程式为_____________。
(3)若验证二氧化碳能与水反应,则C中应装试剂是_________。
(4)将a和d的导管口连接时,观察到D中燃着的蜡烛由低到高逐渐熄灭。说明二氧化碳具有的性质_____________。
【答案】CaCO3+2HCl == CaCl2+H2O+CO2↑ 液体变浑浊 CO2 + Ca(OH)2![]() CaCO3 ↓+ H2O 紫色石蕊溶液 密度比空气的大,不能燃烧也不支持燃烧
CaCO3 ↓+ H2O 紫色石蕊溶液 密度比空气的大,不能燃烧也不支持燃烧
【解析】
(1)实验室制取二氧化碳是用大理石(或石灰石)与稀盐酸反应,大理石(或石灰石)的主要成分是碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl == CaCl2+H2O+CO2↑;
(2)二氧化碳能使澄清的石灰水变浑浊,澄清的石灰水常用来检验二氧化碳,将a和b的导管口连接时,可检验生成的二氧化碳气体 ,则在B中看到的实验现象是液体变浑浊;二氧化碳与氢氧化钙反应生成碳酸钙和水,化学反应方程式为:CO2 + Ca(OH)2![]() CaCO3 ↓+ H2O;
CaCO3 ↓+ H2O;
(3)要验证二氧化碳与水发生反应,可利用二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊溶液变红进行证明,装置C中的溶液为紫色石蕊溶液;
(4)将a和d的导管口连接时,观察到D中燃着的蜡烛由低到高逐渐熄灭。说明二氧化碳具有的性质是密度比空气的大,不能燃烧也不支持燃烧。

 阅读快车系列答案
阅读快车系列答案【题目】“石头纸”就是用磨成粉末的石头为主要原料做成的。这种纸防水坚固不易燃烧,最重要的是不用砍树造纸,非常环保。日程表、便签纸等东西都是以碳酸钙为主要原料的低碳“石头纸”。为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水和盐酸反应):
烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 |
充分反应后生成气体的质量/g | 0.88 | 1.76 | X | 3.52 | 3.52 |
(1)表中X的值为________;
(2)在烧杯_______中碳酸钙完全反应;
(3)求样品中碳酸钙的质量分数_____。