题目内容
X是两种金属氧化物组成的混合物,为了研究混合物的成分,进行了如图所示的实验.
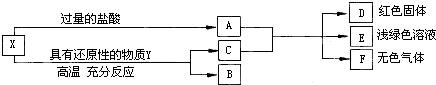
(1)X中含有的金属元素是______(填元素符号).
(2)写出X中一种成分与盐酸反应的化学方程式:______.
(3)若Y为固体,写出Y与X中一种成分反应的化学方程式______;若Y为气体,Y还可以是______(填化学式).

(1)X中含有的金属元素是______(填元素符号).
(2)写出X中一种成分与盐酸反应的化学方程式:______.
(3)若Y为固体,写出Y与X中一种成分反应的化学方程式______;若Y为气体,Y还可以是______(填化学式).
(1)X是两种金属氧化物组成的混合物,与过量的盐酸反应,所得的A中含有多余的盐酸,金属氧化物能被还原性物质还原为相应的金属,得到的C与A混合,得到的E为浅绿色溶液,则E为氯化亚铁,反应后的到的D是红色固体,则D可能是铜,铁能与亚酸反应生成氢气,则F可能是氢气,所以X中含有的金属元素是铁元素和铜元素,所以本题答案为:Fe,Cu;
(2)X中含有氧化铜,能与盐酸反应生成氯化铜和水,所以本题答案为:CuO+2HCl═CuCl2+H2O;
(3)Y为固体,则Y为碳,能与氧化铜反应生成铜和二氧化碳,Y为气体,可以是一氧化碳,所以本题答案为:2CuO+C
| ||

练习册系列答案
相关题目