题目内容
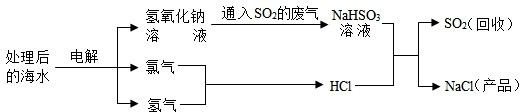
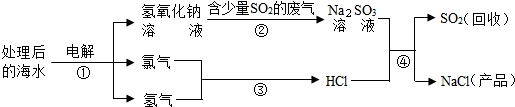
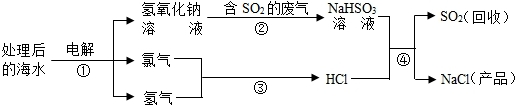
近年来有人提出了利用海水(含氯化钠)处理含二氧化硫的废气,该方法的流程如下:
(1)图中从海水最终得到“NaCl(产品)”的过程属于
(2)图中反应②属于
(3)①中的反应物是氯化钠和
(4)反应④的化学方程式为

(1)图中从海水最终得到“NaCl(产品)”的过程属于
化学变化
化学变化
(填“物理变化”或“化学变化”).(2)图中反应②属于
化合
化合
反应(填反应类型).写出反应③的化学方程式:H2+Cl2
2HCl
| ||
H2+Cl2
2HCl
.
| ||
(3)①中的反应物是氯化钠和
水(H2O)
水(H2O)
,该反应的化学方程式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑
| ||
2NaCl+2H2O
2NaOH+Cl2↑+H2↑
.
| ||
(4)反应④的化学方程式为
NaHSO3+HCl═NaCl+SO2↑+H2O
NaHSO3+HCl═NaCl+SO2↑+H2O
.分析:根据反应物和生成物及其质量守恒定律可以书写化学方程式,根据反应物和生成物的元素组成可以判断反应的类型.
解答:解:(1)由海水制取氯化钠的过程中产生了新物质,是化学变化;
(2)图中②是二氧化硫与氢氧化钠溶液结合成亚硫酸氢钠的反应,反应物是两种,生成物是一种,属于化合反应;
反应③是氢气在氯气中燃烧生成氯化氢,化学方程式为H2+Cl2
2HCl
(3)海水中含有氯化钠,电解海水时生成了氢氧化钠、氢气和氯气,根据反应前后元素种类不变可知反应物中也有钠、氯、氢、氧四种元素,因此反应物为氯化钠和水,化学方程式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑
(4)反应④中亚硫酸氢钠和盐酸反应生成了氯化钠、二氧化硫和水,化学方程式为:NaHSO3+HCl═NaCl+SO2↑+H2O
故答案为:(1)化学变化 (2)化合反应 H2+Cl2
2HCl
(3)水(H2O) 2NaCl+2H2O
2NaOH+Cl2↑+H2↑
(4)NaHSO3+HCl═NaCl+SO2↑+H2O
(2)图中②是二氧化硫与氢氧化钠溶液结合成亚硫酸氢钠的反应,反应物是两种,生成物是一种,属于化合反应;
反应③是氢气在氯气中燃烧生成氯化氢,化学方程式为H2+Cl2
| ||
(3)海水中含有氯化钠,电解海水时生成了氢氧化钠、氢气和氯气,根据反应前后元素种类不变可知反应物中也有钠、氯、氢、氧四种元素,因此反应物为氯化钠和水,化学方程式为2NaCl+2H2O
| ||
(4)反应④中亚硫酸氢钠和盐酸反应生成了氯化钠、二氧化硫和水,化学方程式为:NaHSO3+HCl═NaCl+SO2↑+H2O
故答案为:(1)化学变化 (2)化合反应 H2+Cl2
| ||
(3)水(H2O) 2NaCl+2H2O
| ||
(4)NaHSO3+HCl═NaCl+SO2↑+H2O
点评:本题主要考查了化学方程式的书写及其物质变化的分类等方面的内容

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目