题目内容
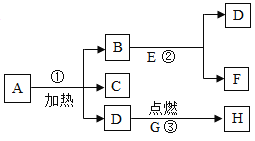
【题目】已知:A-G物质的组成元素均为前18号元素,其转化关系如下图所示,A是一种生活中常见的动植物生存所必需的液态物质,D为黑色固体单质,E为无色气体,F为不溶于水的白色沉淀CaCO3,G与A的组成元素相同且为无色液体,H为黑色粉末状物质。请回答下列问题:
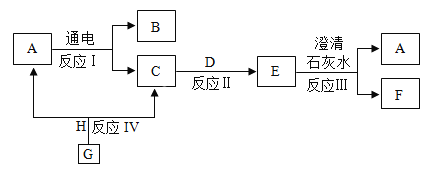
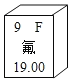
(1)物质E的化学式为_____、物质B在物质分类中的类别_____。
(2)反应Ⅰ的化学方程式为_____,反应Ⅱ的反应类型为_____,反应Ⅲ的化学方程式为_____。
(3)已知反应前后元素化合价有变化的化学反应是氧化还原反应,则反应Ⅰ、Ⅱ、Ⅲ、Ⅳ中,不属于氧化还原反应的有_____(填反应编号)。
【答案】CO2 单质(或纯净物) 2H2O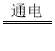 2H2↑ + O2↑ 化合反应 CO2+Ca(OH)2=CaCO3↓+H2O Ⅲ
2H2↑ + O2↑ 化合反应 CO2+Ca(OH)2=CaCO3↓+H2O Ⅲ
【解析】
A是一种生活中常见的动植物生存所必需的液态物质,则A是水;水通电可以分解产生氢气和氧气,则B是氢气,C是氧气,氧气与黑色固体单质D反应生成无色气体E,E与澄清的石灰水反应生成不溶于水的白色沉淀F,F是CaCO3,则E是二氧化碳,D是碳,G与水的组成元素相同且为无色液体,则G是过氧化氢;H为黑色粉末状物质,则H是二氧化锰。
(1)物质E的化学式为CO2、物质B是氢气,在物质分类中的类别中属于纯净物,也属于单质;
(2)反应Ⅰ中水通电产生氢气和氧气的化学方程式为2H2O 2H2↑ + O2↑,反应Ⅱ碳在氧气中燃烧生成二氧化碳气体C+O2
2H2↑ + O2↑,反应Ⅱ碳在氧气中燃烧生成二氧化碳气体C+O2![]() CO2反应符合“多变一”,属于化合反应,反应Ⅲ二氧化碳与氢氧化钙溶液反应生成碳酸钙和水的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
CO2反应符合“多变一”,属于化合反应,反应Ⅲ二氧化碳与氢氧化钙溶液反应生成碳酸钙和水的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(3)已知反应前后元素化合价有变化的化学反应是氧化还原反应,则反应Ⅰ、Ⅱ、Ⅲ、Ⅳ中,反应Ⅲ中CO2+Ca(OH)2=CaCO3↓+H2O,各元素化合价都没又发生改变,不属于氧化还原反应。

 阅读快车系列答案
阅读快车系列答案【题目】高锰酸钾在生产、生活中有广泛应用。实验小组对高锰酸钾某些性质进行研究。
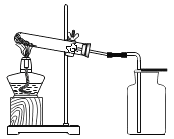
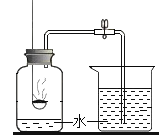
I.不稳定性:如图所示进行实验
(1)高锰酸钾受热分解的文字表达式为____________________属于的基本反应类型是__________________
(2)判断O2是否集满的方法是____________________
(3)将高锰酸钾加入到氯酸钾中也能加快氯酸钾的分解速率,高锰酸钾是否是氯酸钾分解的催化剂,并说明理由_______________
II.腐蚀性
[查阅资料]①高锰酸钾溶液呈中性、有腐蚀性。
②浓硫酸加入水中会稀释成稀硫酸,常温下铜片不与稀硫酸反应。
[进行实验]将铜片分别浸泡在4种溶液中进行实验,所得数据如下表。
编号 | ① | ② | ③ | ④ | |
实验 |
|
|
|
| |
铜片 | 实验前 | 0.54 | 0.54 | 0.54 | 0.54 |
18小时后 | 0.54 | 0.52 | 0.54 | 0.43 | |
[解释与结论]
(4)通过对比②和④,得出的结论是_____________
(5)欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要对比____________(填编号)
【题目】某实验小组用3克氯酸钾和二氧化锰混合物进行实验,加热该混合物t1时间后(杂质不反应),冷却,称量剩余固体的质量,重复以上操作,依次加热t2、t3、t4时间后测得剩余固体的质量,记录数据如下表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 2.68 | 2.36 | 2.04 | 2.04 |
(1)加热t3时间后氯酸钾是否分解完全?_________(填“是”或“否”)
(2)完全反应后产生氧气的质量为_____________克;
(3)该混合物中氯酸钾的质量为_____?