题目内容
某NaOH固体样品已部分变质.常温下,取61.2g该样品溶于水得到1000g溶液,取出500g溶液进行测定,其中含Na元素16.1g,碳元素1.2g,则原NaOH固体样品中NaOH的质量分数为
- A.65.4%
- B.34.6%
- C.82.3%
- D.64.5%
A
分析:氢氧化钠部分变质是有部分氢氧化钠和空气中的二氧化碳反应生成了碳酸钠,利用碳酸钠化学式中碳和钠的质量比,根据碳元素质量可求出钠元素的质量,然后用钠元素的总质量减去碳酸钠中钠元素的质量,就得到氢氧化钠中钠元素的质量,然后求出氢氧化钠的质量,最后进一步求出氢氧化钠的质量分数.
解答:设Na2CO3中钠元素的质量为x
根据Na2CO3中碳元素和钠元素的质量比可得: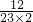 =
=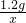
解得x=4.6g
所以氢氧化钠中钠元素的质量为16.1g-4.6g=11.5g
根据NaOH的化学式可得NaOH中钠元素的质量分数为: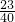 ×100%=57.5%
×100%=57.5%
所以氢氧化钠的质量为: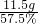 =20g
=20g
这是500g溶液中所含氢氧化钠的质量,那么在1000g溶液中含有的氢氧化钠应该为40g
那么原固体样品中氢氧化钠的质量分数为: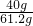 ×100%=65.4%
×100%=65.4%
故选A
点评:此题考查的是混合物中所含某种物质质量分数的计算,其中利用了通过化学式求元素的质量比,及通过化学式求某元素的质量分数这两个基础知识点,很好的练习了学生们对基础知识的掌握.
分析:氢氧化钠部分变质是有部分氢氧化钠和空气中的二氧化碳反应生成了碳酸钠,利用碳酸钠化学式中碳和钠的质量比,根据碳元素质量可求出钠元素的质量,然后用钠元素的总质量减去碳酸钠中钠元素的质量,就得到氢氧化钠中钠元素的质量,然后求出氢氧化钠的质量,最后进一步求出氢氧化钠的质量分数.
解答:设Na2CO3中钠元素的质量为x
根据Na2CO3中碳元素和钠元素的质量比可得:
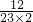 =
=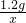
解得x=4.6g
所以氢氧化钠中钠元素的质量为16.1g-4.6g=11.5g
根据NaOH的化学式可得NaOH中钠元素的质量分数为:
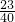 ×100%=57.5%
×100%=57.5%所以氢氧化钠的质量为:
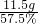 =20g
=20g这是500g溶液中所含氢氧化钠的质量,那么在1000g溶液中含有的氢氧化钠应该为40g
那么原固体样品中氢氧化钠的质量分数为:
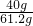 ×100%=65.4%
×100%=65.4%故选A
点评:此题考查的是混合物中所含某种物质质量分数的计算,其中利用了通过化学式求元素的质量比,及通过化学式求某元素的质量分数这两个基础知识点,很好的练习了学生们对基础知识的掌握.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
某NaOH固体样品已部分变质.常温下,取61.2g该样品溶于水得到1000g溶液,取出500g溶液进行测定,其中含Na元素16.1g,碳元素1.2g,则原NaOH固体样品中NaOH的质量分数为( )
| A、65.4% | B、34.6% | C、82.3% | D、64.5% |