��Ŀ����
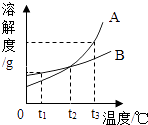
����Ŀ�����������ڹ���������������Ҫ�����ã���ͼΪ�ߩ�15�ɻ�������������ɣ� 
��1�����Ͻ���������ɻ�����ǣ����Ͻ���ʵ���Ҫ�ŵ��� ��
��2����������ʴ��Ҫ����������е���ͬ���õĽ��
��3��Ϊ�˱����ִ��ĸ�����DZ���ʴ��ͨ�����ִ��������Ƕ�������ǿ�Ľ�����С��Ϊ̽��п������ͭ���ֽ����Ļ��˳���������ͼ2������ʵ�飺 ��ʵ��һ�У�С���ԡ���������������ݵĿ�����Ϊ�����ж�п�����Ļ��ǿ������ͬѧ��Ϊ���������������� ��
��ʵ����У�����������֤�����Ļ��ǿ��ͭ��
��4���������Ľ���ķ��˴����ĸֲģ�ij��ȤС����ʵ������ͼ3��ʾװ��ģ�������Ļ�ѧԭ����װ��A���������Ļ�ѧ����ʽΪ �� װ��B�з�Ӧ�����Ļ�ѧ����ʽΪ ��
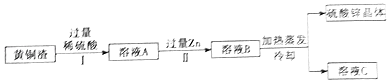
��5��ij��ѧ��ȤС���ijͭп�Ͻ���Ʒ����̽��ʵ�飮��ȡ��Ʒ10.0g������100.0gϡ������Һ��ε��룬ʵ�������ͼ4��ʾ��������ϡ������Һ�����ʵ�����������
���𰸡�
��1�����ᡢǿ�ȴ�
��2��ˮ������
��3�����õ��ͬ��û�п��Ʊ������к�ɫ��������
��4��Fe2O3+3CO ![]() 2Fe+3CO2��2NaOH+CO2�TNa2CO3+H2O
2Fe+3CO2��2NaOH+CO2�TNa2CO3+H2O
��5���⣺��ͼ��֪�����������10g��3.5g=6.5g����ͭп�Ͻ���ֻ��п���ܺ����ᷴӦ���ܽ⣬���Կ�֪п������Ϊ6.5g
�������ĵ������е����ʵ�����Ϊy��
Zn+ | H2SO4=ZnSO4+H2�� |
65 | 98 |
6.5g | y |
![]() =
= ![]()
y=9.8g
���ڷ�Ӧ�ڼ�������50gʱ�Ѿ���Ӧ���
��������ϡ������Һ�����ʵ���������Ϊ ![]() ��100%=19.6%
��100%=19.6%
���������⣺��1�����Ͻ���������ɻ�����ǣ����ڷɻ���Ҫ��������ǿ�ȴ����Կ����Ƶ����Ͻ���ʵ���Ҫ�ŵ��� ���ᡢǿ�ȴ�2����������ʴ��Ҫ����������е�ˮ��������ͬ���õĽ������3����ʵ��һ�У�С���ԡ���������������ݵĿ�����Ϊ�����ж�п�����Ļ��ǿ�������������ͬ�����Ե������γɺ������ۣ���ʵ����У������� �к�ɫ������������֤�����Ļ��ǿ��ͭ����4���������Ľ���ķ��˴����ĸֲģ�ij��ȤС����ʵ������ͼ3��ʾװ��ģ�������Ļ�ѧԭ����װ��A������������һ����̼�ڸ������������Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ Fe2O3+3CO ![]() 2Fe+3CO2 �� װ��B�������ɵĶ�����̼�������������գ�������̼���ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ 2NaOH+CO2�TNa2CO3+H2O����5��
2Fe+3CO2 �� װ��B�������ɵĶ�����̼�������������գ�������̼���ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ 2NaOH+CO2�TNa2CO3+H2O����5��
���Դ��ǣ���1�����ᡢǿ�ȴ�2��ˮ����������3�����õ��ͬ��û�п��Ʊ����� �к�ɫ������������4��Fe2O3+3CO ![]() 2Fe+3CO2��2NaOH+CO2�TNa2CO3+H2O����5��19.6%��
2Fe+3CO2��2NaOH+CO2�TNa2CO3+H2O����5��19.6%��
�����㾫�������úϽ�Ķ��������ܺ��ݻ�ѧ��Ӧ����ʽ�ļ������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪�Ͻ���һ�ֽ���������һ�ֻ��ֽ������������ǽ�����һ���ۺ϶��ɵľ��н������Ե����ʣ�һ��˵�����Ͻ���۵�ȸ��ɷֵͣ�Ӳ�ȱȸ��ɷִ���ʴ���ܸ��ã������ʼ�������=ϵ������Է�������֮�ȣ�