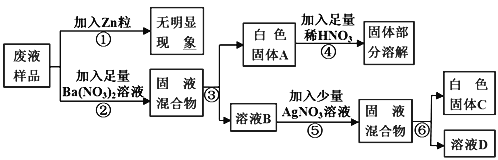
题目内容
【题目】下图是干电池的截面示意图。废旧电池也是资源,将其回收利用对保护环境具有重要意义。请结合示意图回答下列问题:
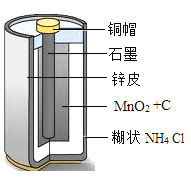
(1)碳棒(主要成分是石墨)用作电极,是利用石墨的_________________性。
(2)将电池填充物(MnO2、C及NH4Cl的混合物)加水溶解、过滤,可得到NH4Cl溶液。NH4Cl还可用作化肥使用,属于化肥中的_____________肥。
(3)干电池中含有金属铜和锌。以下能证明铜、锌金属活动性强弱的试剂组合是_______(填序号)。
A.锌、铜和稀硫酸 B.锌和氯化铜溶液 C.铜和硫酸锌溶液
(4)将mgZn和Fe的混合物加入到一定质量的CuCl2溶液中,充分反应后过滤,将滤渣洗涤、干燥后称量。质量仍为mg,对所得溶液和滤渣有如下四种判断:
A、滤液可能是无色
B、滤液中一定有ZnCl2和FeCl2
C、滤液中的物质可能有3种
D、滤液中加稀盐酸一定有气泡产生
以上判断正确的是___________(填序号)。
【答案】 导电 氮 ABC BC
【解析】(1)石墨具有导电性,可以做电极;
(2)氯化铵中含有的营养元素只有氮元素,故是氮肥;
(3)A、锌可以和稀硫酸反应有气泡冒出,而铜不能和稀硫酸反应,故可以证明;
B、锌可以与氯化铜反应置换出铜,可以证明锌比铜活泼;
C、铜不能将锌从硫酸锌中置换出来,可以证明锌比铜活泼;故选ABC ;
(4)锌和铁都可以和氯化铜反应,铁的相对原子质量比铜小,锌的相对原子质量比铜大,在金属活动性顺序中,锌比铁活泼,故锌先与氯化铜反应,如只有锌参加反应,则生成的固体的质量大于mg ,故铁也一定参加了反应,故滤液不可能是无色的;锌和铁都与氯化铜发生了反应,故滤液中一定有氯化锌和氯化亚铁;当氯化铜过滤时,滤液中可能有氯化铜、氯化锌和氯化亚铁;滤液中加入稀盐酸不可能有气体生成,故选BC 。

【题目】鸡蛋主要由蛋壳、蛋壳膜、蛋白、蛋黄等几个部分组成,其中蛋壳的主要成分是CaCO3,里面覆盖一层蛋壳膜。化学活动兴趣小组的同学开展了以下探究活动:
【提出问题】蛋壳中的CaCO3含量是多少?

【查阅资料】
a、蛋壳经过科学检测其中含CaCO3的质量分数约为82%~85%,含蛋白质质量分数约14-17%。
b、蛋壳膜中蛋白质含量约为90%~93%。
c、Ba(OH)2是一种碱,化学性质与Ca(OH)2相似。
【设计方案】
方案一:用“灼烧法”,将该蛋壳放在空气中充分灼烧并采集相关数据进行测定。
方案二:用“酸处理法”,将蛋壳与稀盐酸反应后再进行吸收转变为碳酸钡进行测量处理。
【进行实验】
方案一:称取12.0 g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16 g。
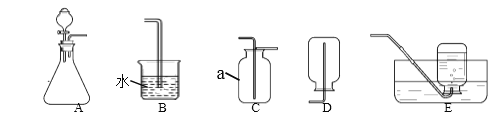
方案二:用下图所示的连接实验装置,称取12 g蛋壳样品进行实验(假设其他成分均不与HCl反应,装置内试剂均足量。)
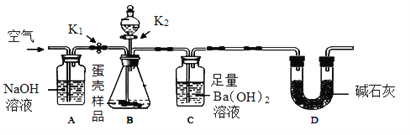
【实验步骤】
① 按上图连接好装置后,并检查装置的气密性;
② 向B装置中加入蛋壳样品后,先通入一会儿空气;
③ 关闭K1,打开K2,向蛋壳样品中滴入10%的盐酸,直到__________为止;
④ 关闭K2,打开K1,再缓缓通入空气一会儿,至装置C中不再产生沉淀为止;
⑤ 将装置C中的固液混合物进行过滤、__________、烘干后称量其质量;
⑥ 重复上述实验。
【数据处理】
方案一:产生的CO2质量__________g,蛋壳中的CaCO3的质量分数为__________%。(保留一位小数)
方案二:重复3次实验,记录数据如下:
实验次数 | 第1次 | 第2次 | 第3次 |
装置C中沉淀质量(/g) | 19.68 | 19.75 | 19.67 |
方案二:实验测得蛋壳中的CaCO3的质量分数__________(写出计算过程,)
(已知:Mr(CaCO3):100 Mr(BaCO3):197)
【评价反思】
(1)方案二中装置D的作用是__________。
(2)方案一测定值与科学检测的数据有较大误差,主要原因是__________。
【题目】下列实验方法一定能达到实验目的的是
选项 | 实验目的 | 实验方法 |
A | 检验一瓶气体是否为 | 将燃着的木条伸入瓶中 |
B | 鉴别 | 分别点燃,在火焰上方罩一干冷烧杯 |
C | 鉴别石灰水和 | 加入适量的稀盐酸 |
D | 比较Zn、Cu、Ag的金属活动性 | 将Zn和Ag分别放入 |