题目内容
(2010?内江)化学兴趣小组的同学准备自制氢气做氢气球.他们取用铁丝和铝条打磨后,分别放入盛有稀盐酸的试管中,发现铁丝只有细小的气泡缓慢产生,而铝条迅速反应,产生的气泡混合酸一起冲出试管,他们一筹莫展,你能帮助他们吗?
(1)根据金属活动性顺序,你认为选择金属
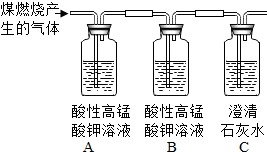
(2)如果要组装一个能即制即停的装置,可以选择下列装置中的

(3)这样制得的氢气中可能含有氯化氢和水蒸气等杂质,将所得气体先通入
(1)根据金属活动性顺序,你认为选择金属
锌
锌
可能更为合适.按照你的选择,写出反应的化学方程式Zn+2HCl═ZnCl2+H2↑
Zn+2HCl═ZnCl2+H2↑
.(2)如果要组装一个能即制即停的装置,可以选择下列装置中的
C
C
.
(3)这样制得的氢气中可能含有氯化氢和水蒸气等杂质,将所得气体先通入
氢氧化钠
氢氧化钠
溶液,再通入浓硫酸
浓硫酸
即可得到纯净的氢气.分析:(1)根据铁、铝与盐酸反应的现象以及金属活动性顺序选择合适的金属;
(2)根据C装置的优点:关闭开关,随着试管内部气体的增多,压强也随之增大,阻止漏斗液体下流,使反应停止,所以可随时控制反应的进行;
(3)根据氢氧化钠溶液可以与氯化氢反应,浓硫酸能吸水分析;
(2)根据C装置的优点:关闭开关,随着试管内部气体的增多,压强也随之增大,阻止漏斗液体下流,使反应停止,所以可随时控制反应的进行;
(3)根据氢氧化钠溶液可以与氯化氢反应,浓硫酸能吸水分析;
解答:解:(1)由以上铁、铝和盐酸反应出现太慢或太快现象,所以根据金属活动性顺序,选择金属锌更合适,锌与盐酸反应生成氯化锌和氢气,故答案为:锌;Zn+2HCl═ZnCl2+H2↑;
(2)C装置有个开关,假如关闭开关,随着试管内部气体的增多,压强也随之增大,阻止漏斗液体下流,使反应停止,所以可随时控制反应的进行,随开随停.故答案为:C;
(3)氢氧化钠溶液可以与氯化氢反应,浓硫酸能吸水,所以混合气体先通入氢氧化钠溶液,再通入浓硫酸即可得到纯净的氢气.故答案为:氢氧化钠;浓硫酸;
(2)C装置有个开关,假如关闭开关,随着试管内部气体的增多,压强也随之增大,阻止漏斗液体下流,使反应停止,所以可随时控制反应的进行,随开随停.故答案为:C;
(3)氢氧化钠溶液可以与氯化氢反应,浓硫酸能吸水,所以混合气体先通入氢氧化钠溶液,再通入浓硫酸即可得到纯净的氢气.故答案为:氢氧化钠;浓硫酸;
点评:本题知道了制取气体的药品的和发生装置的选择,进一步练习了方程式的书写方法,除杂质的方法.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目