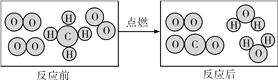
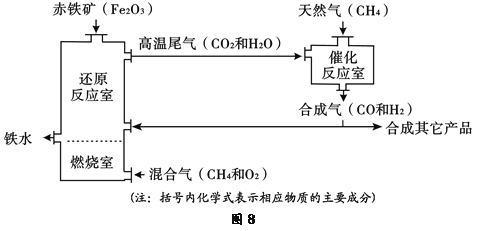
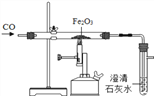
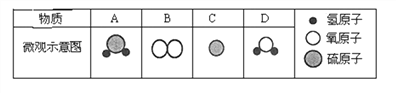
题目内容
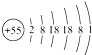
【题目】黄铜(铜锌合金)是重要的金属材料,常用来制造机械零件,仪表和日用品。为测定黄铜材料中锌的含量,化学研究小组进行了实验:称取15.0g 此黄铜材料,向其中逐渐加入稀盐酸,测定产生气体的质量和加入稀盐酸的质量,并根据实验情况绘制了产生气体质量与加入稀盐酸的关系图。请你仔细分析此关系图,并进行计算:
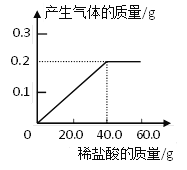
(1)15.0g黄铜材料中含锌___________g。
(2)稀盐酸中溶质的质量分数为__________(写出计算过程,下同。)
(3)当两者恰好完全反应时,求所得溶液的溶质质量分数为__________。
【答案】 6.5g 18.25% 29.4%
【解析】(1)黄铜中的锌与稀盐酸反应生成氢气,铜与稀盐酸不反应。根据氢气的质量可求出锌的质量。设15.0g黄铜材料中含锌的质量为x,
Zn+2HCl==ZnCl2+H2↑
65 2
x 0.2g
![]() =
=![]() ,解得x=6.5g
,解得x=6.5g
(2)设稀盐酸中溶质的质量为y
Zn+2HCl==ZnCl2+H2↑
73 2
y 0.2g
![]() =
=![]() ,解得y=7.3g
,解得y=7.3g
稀盐酸中溶质的质量分数为: ![]() ×100%=18.25%
×100%=18.25%
(3)设当两者恰好完全反应时,所得溶液的溶质质量为z
Zn+2HCl==ZnCl2+H2↑
136 2
z 0.2g
![]() =
=![]() ,解得z=13.6g
,解得z=13.6g
根据质量守恒定律,反应后所得溶液的质量为:6.5g+40g-0.2g=46.3g
所以恰好完全反应时,所得溶液的溶质质量分数为: ![]() ×100%=29.4%
×100%=29.4%

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目