题目内容
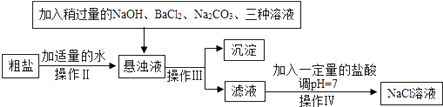
【题目】工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液),主要生产流程如图所示: 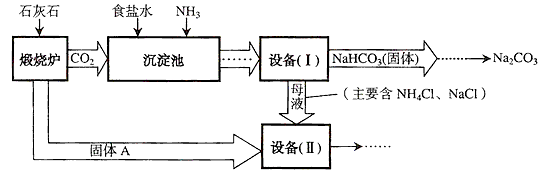
(已知2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O)
CaCl2+2NH3↑+2H2O)
(1)“煅烧炉”中发生反应的化学方程式是。
(2)若在实验室里分离“设备(I)”中的混合物,用到的操作名称是。
(3)“沉淀池”中的反应是在加压的条件下不断向食盐水和饱和氨水溶液中通入二氧化碳气体,试分析该流程需要加压条件的原因是。
(4)“设备(Ⅱ)”中固体A与水反应的化学方程式是。
(5)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有(填写化学式)。
(6)请写出一个该生产流程的优点:。
【答案】
(1)CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
(2)过滤
(3)增大二氧化碳的溶解度
(4)H2O+CaO=Ca(OH)2
(5)NH3、NaCl
(6)原料便宜易得(或者有物质可以循环利用)
【解析】(1)石灰石的主要成分是碳酸钙,在高温条件下发生分解反应生成氧化钙和二氧化碳气体。(2)通过过滤可将难溶性的固体与液体分离。(3)压强越大气体的溶解度越大。(4)“设备(Ⅱ)”中固体A是氧化钙,与水反应生成氢氧化钙。(5) NH3、NaCl是反应所用的原料。(6)该生产流程的优点是有的物质可以循环利用。
故答案为:(1)CaCO3 ![]() CaO+CO2↑(2)过滤(3)增大二氧化碳的溶解度(4)H2O+CaO=Ca(OH)2(5)NH3、NaCl(6)原料便宜易得(或者有物质可以循环利用)(1)根据碳酸钙高温分解产生氧化钙和二氧化碳解答
CaO+CO2↑(2)过滤(3)增大二氧化碳的溶解度(4)H2O+CaO=Ca(OH)2(5)NH3、NaCl(6)原料便宜易得(或者有物质可以循环利用)(1)根据碳酸钙高温分解产生氧化钙和二氧化碳解答
(2)根据过滤的原理和适用范围解答
(3)根据影响气体溶解度的因素解答
(4)根据反应物、生成物、反应条件写出方程式
(5)根据生产流程中有些物质可循环解答
(6)根据生产过程中使用的原料成本,以及生产流程中有些物质可循环解答

【题目】下表列举了法拉第《蜡烛的故事》中涉及的部分问题及对问题的回答,其中“对问题的回答”属于“设计实验方案”的是( )
选项 | 问题 | 对问题的回答 |
A | 火焰不同部位温度高低如何比较? | 用一火柴梗平放入火焰中,观察火柴梗不同部位的烧灼情况 |
B | 火焰为什么向上? | 热气流上升,形成对流 |
C | 火焰明亮的原因是什么? | 与火焰中的碳颗粒有关,碳颗粒会影响火焰明亮程度 |
D | 吹灭蜡烛时产生的白烟是什么? | 主要成分是石蜡蒸气凝结成的石蜡固体小颗粒 |
A.AB.BC.CD.D