题目内容
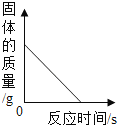
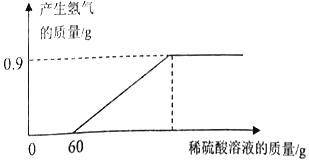
【题目】小东在帮助老师整理化学实验室时,发现一块锈蚀非常严重的铝片(表面只有氧化铝,没有其他杂质)。小东先准确称量该锈蚀的铝片质量为13.2g。然后利用一瓶未知浓度的稀硫酸来测定该铝片的锈蚀程度,并测定了该稀硫酸溶质的质量分数。如图是小东实验过程中画出的随稀硫酸质量增加产生氢气质量的变化图象。请回答下列问题:
(1)日常生活中铝制品生锈后,无需除掉锈迹的原因是______。
(2)经实验测定,该铝片中未生锈的铝的质量为______g(无需写出计算过程)。
(3)计算所用稀硫酸溶质的质量分数并写出详细的解题步骤_____。
【答案】铝生锈会在表面形成一层致密的保护膜,从而阻止铝进一步被锈蚀 8.1 24.5%
【解析】
解:(1)铝生锈会在表面形成一层致密的保护膜,从而阻止铝进一步被锈蚀;
(2)由图象可知反应中生成的氢气质量是0.9g
设反应的铝的质量是x
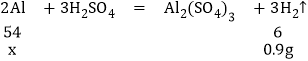
![]()
x=8.1g
(3)铝片中的氧化铝质量是13.2g-8.1g=5.1g
设硫酸的质量分数是y
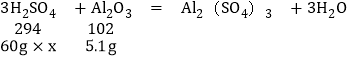
![]()
x=24.5%
故答案为:(1)铝生锈会在表面形成一层致密的保护膜,从而阻止铝进一步被锈蚀;(2)8.1;(3)所用稀硫酸溶质的质量分数为24.5%
(1)依据铝生锈的特点分析解答;
(2)依据图象中氢气的质量可求反应的铝的质量;
(3)依据与氧化铝反应的硫酸质量可求硫酸的溶质质量分数;

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】(5分)下表是元素周期表的一部分,请你根据下表回答问题:
3 Li 锂 6.941 | 4Be[来铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟[来 19.00 | 10 Ne 氖 20.18 |
11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 29.95 |
(1)根据上表回答问题
①钠的相对原子质量是 。
②上表中,金属元素有 种。
(2)图甲是某元素在元素周期表中的部分信息,图乙是该元素的一种粒子结构示意图。
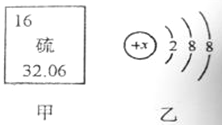
①该元素的原子的核电荷数为 ,该原子的最外层电子数为 。
②图乙所示粒子的符号为 。