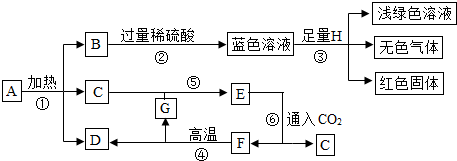
题目内容
已知A~G七种物质都是初中化学课本中出现过的化合物,其中F是常用的建筑材料,H为常见的单质,各物质之间存在如下转化关系(反应条件如图所示).

(1)写出物质的化学式:B
(2)写出化学方程式及其所属基本反应类型:
②
③
④
(3)反应①是分解反应,物质A中包含的元素有

(1)写出物质的化学式:B
CuO
CuO
,ECa(OH)2
Ca(OH)2
,FCaCO3
CaCO3
,DCO2
CO2
,蓝色溶液中的溶质包含CuSO4、H2SO4
CuSO4、H2SO4
.(2)写出化学方程式及其所属基本反应类型:
②
H2SO4+CuO═CuSO4+H2O
H2SO4+CuO═CuSO4+H2O
,属于复分解
复分解
反应.③
Fe+CuSO4=Cu+FeSO4,Fe+H2SO4=FeSO4+H2↑
Fe+CuSO4=Cu+FeSO4,Fe+H2SO4=FeSO4+H2↑
,属于置换
置换
反应.④
CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
,属于
| ||
分解
分解
反应.(3)反应①是分解反应,物质A中包含的元素有
Cu、C、H、O
Cu、C、H、O
.分析:首先,依据物质的特性,找出突破口,F是常用的建筑材料,所以为碳酸钙,再根据蓝色溶液是铜离子的溶液,浅绿色溶液是亚铁离子溶液,红色固体通常是铜,再根据物质间的反应进一步进行推断.
解答:解:
由于F是常用的建筑材料,所以F为碳酸钙,碳酸钙高温生成氧化钙、二氧化碳,即GD应该为二氧化碳和氧化钙,由于E通入二氧化碳生成F碳酸钙,推出E是氢氧化钙,C是水,C和G反应生成氢氧化钙,所以G是氧化钙,D是二氧化碳;
B与过量稀硫酸反应,得到蓝色溶液,由于蓝色溶液是铜离子的溶液,所以蓝色溶液是硫酸铜溶液,里面还有过量的稀硫酸;
H是单质并且与蓝色溶液反应,生成浅绿色溶液、无色气体、红色固体,所以H是铁,浅绿色溶液是硫酸亚铁、无色气体是氢气、红色固体是铜;
由于B与过量硫酸反应生成硫酸铜,且B是一个分解反应得到的三种物质之一,即一定为碱式碳酸铜分解的结果,所以B是氧化铜;
因为A加热生成氧化铜、水、二氧化碳,所以A是碱式碳酸铜.
故答案为:
(1)CuO;Ca(OH)2;CaCO3; CO2;CuSO4、H2SO4
(2)H2SO4+CuO═CuSO4+H2O 复分解
Fe+CuSO4=Cu+FeSO4,Fe+2HCl=FeCl2+H2↑置换
CaCO3
CaO+CO2↑ 分解
(3)Cu、C、H、O
由于F是常用的建筑材料,所以F为碳酸钙,碳酸钙高温生成氧化钙、二氧化碳,即GD应该为二氧化碳和氧化钙,由于E通入二氧化碳生成F碳酸钙,推出E是氢氧化钙,C是水,C和G反应生成氢氧化钙,所以G是氧化钙,D是二氧化碳;
B与过量稀硫酸反应,得到蓝色溶液,由于蓝色溶液是铜离子的溶液,所以蓝色溶液是硫酸铜溶液,里面还有过量的稀硫酸;
H是单质并且与蓝色溶液反应,生成浅绿色溶液、无色气体、红色固体,所以H是铁,浅绿色溶液是硫酸亚铁、无色气体是氢气、红色固体是铜;
由于B与过量硫酸反应生成硫酸铜,且B是一个分解反应得到的三种物质之一,即一定为碱式碳酸铜分解的结果,所以B是氧化铜;
因为A加热生成氧化铜、水、二氧化碳,所以A是碱式碳酸铜.
故答案为:
(1)CuO;Ca(OH)2;CaCO3; CO2;CuSO4、H2SO4
(2)H2SO4+CuO═CuSO4+H2O 复分解
Fe+CuSO4=Cu+FeSO4,Fe+2HCl=FeCl2+H2↑置换
CaCO3
| ||
(3)Cu、C、H、O
点评:解物质的推断题时,先根据物质的特性和用途等找出解题的突破口,再根据物质间的反应逐一分析.

练习册系列答案
相关题目