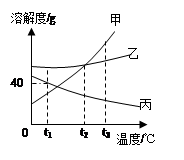题目内容
某实验小组对不同条件下的硝酸钾的溶解情况进行了以下实验。
在甲乙丙三个烧杯中放入20g硝酸钾晶体,再分别加入50.0g冷水、热水与酒精,充分搅拌后(保持各自的温度不变),结果如下图所示。

(1)甲烧杯中溶液是_______(填“饱和”或“不饱和”)溶液。
(2)由以上实验可得出结论:影响物质溶解度的因素有_______、__________.
(3)将乙烧杯中的溶液降温到t1。C时,硝酸钾的溶解度是______g/100g水。再往乙烧杯中加入10g水,改变温度至t2 C时,溶液又恰好达到饱和状态,则t1____t2(填“>”、“<”或“=”)。
(4)经实验测定,获得不同温度时硝酸钾的溶解度数据。

(5)分析上述数据,某温度时的硝酸钾溶解度数据可能存在较大的误差,该温度时________。C.
(6)请根据表中的数据,在坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线。
在甲乙丙三个烧杯中放入20g硝酸钾晶体,再分别加入50.0g冷水、热水与酒精,充分搅拌后(保持各自的温度不变),结果如下图所示。

(1)甲烧杯中溶液是_______(填“饱和”或“不饱和”)溶液。
(2)由以上实验可得出结论:影响物质溶解度的因素有_______、__________.
(3)将乙烧杯中的溶液降温到t1。C时,硝酸钾的溶解度是______g/100g水。再往乙烧杯中加入10g水,改变温度至t2 C时,溶液又恰好达到饱和状态,则t1____t2(填“>”、“<”或“=”)。
(4)经实验测定,获得不同温度时硝酸钾的溶解度数据。

(5)分析上述数据,某温度时的硝酸钾溶解度数据可能存在较大的误差,该温度时________。C.
(6)请根据表中的数据,在坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线。
| 温度 | 溶解度(g/100g水) |
| 20 | 31.6 |
| 40 | 63.9 |
| 50 | 145 |
| 60 | 110 |
| 70 | 140 |
| 80 | 169 |
(1)饱和 (2)温度 (3)溶剂种类 (4)40.0 (5)> (6)50


(1)在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做这种溶质的饱和溶液。在一定温度下,向一定量溶剂里加入某种溶质,当溶质能继续溶解时,所得的溶液叫做这种溶质的不饱和溶液。在甲中,烧杯内存在未溶解的硝酸钾晶体,说明硝酸钾在现有条件无法继续溶解,所以甲烧杯中的溶液是饱和溶液。
(2)甲、乙相比可知,甲中有少量的硝酸钾晶体,乙中没有硝酸钾晶体;二者水的质量相同,水的温度不同。可以看出硝酸钾晶体的溶解度受温度的影响。
(3)甲、丙相比可知,甲中有少量的硝酸钾晶体,丙中存有较多的硝酸钾晶体;二者温度相同,甲的溶剂是水,丙的溶剂是酒精,二者的质量相同。可以看出硝酸钾晶体的溶解度受溶剂种类的影响。
(4)乙烧杯中的溶液降温到t1℃时,溶液恰好饱和。
设t1℃时,硝酸钾的溶解度为x,则

可解得,x=40.0g
(5)再往乙烧杯中加入10g水,改变温度至t2℃时,溶液又恰好达到饱和状态。说明t2℃溶液达到饱和状态时,比t1℃时溶剂(水)多了10g,即t2℃时硝酸钾的溶解度小于t1℃时。根据硝酸钾的溶解度变化特点可知t1>t2.
(6)由表中数据可知,硝酸钾在水中的溶解度随着温度的增加而不断升高。其中50℃时,数据明显不符合此规律,所以50。C时硝酸钾溶解度数据可能存在较大的误差。
绘制溶解度曲线时,先根据表中数据进行描点(50℃不能采用表中数据),再将描的点用平滑的曲线进行连接。
点评:要准确掌握溶解度、溶解度曲线的意义(点、线)。
(2)甲、乙相比可知,甲中有少量的硝酸钾晶体,乙中没有硝酸钾晶体;二者水的质量相同,水的温度不同。可以看出硝酸钾晶体的溶解度受温度的影响。
(3)甲、丙相比可知,甲中有少量的硝酸钾晶体,丙中存有较多的硝酸钾晶体;二者温度相同,甲的溶剂是水,丙的溶剂是酒精,二者的质量相同。可以看出硝酸钾晶体的溶解度受溶剂种类的影响。
(4)乙烧杯中的溶液降温到t1℃时,溶液恰好饱和。
设t1℃时,硝酸钾的溶解度为x,则

可解得,x=40.0g
(5)再往乙烧杯中加入10g水,改变温度至t2℃时,溶液又恰好达到饱和状态。说明t2℃溶液达到饱和状态时,比t1℃时溶剂(水)多了10g,即t2℃时硝酸钾的溶解度小于t1℃时。根据硝酸钾的溶解度变化特点可知t1>t2.
(6)由表中数据可知,硝酸钾在水中的溶解度随着温度的增加而不断升高。其中50℃时,数据明显不符合此规律,所以50。C时硝酸钾溶解度数据可能存在较大的误差。
绘制溶解度曲线时,先根据表中数据进行描点(50℃不能采用表中数据),再将描的点用平滑的曲线进行连接。
点评:要准确掌握溶解度、溶解度曲线的意义(点、线)。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目