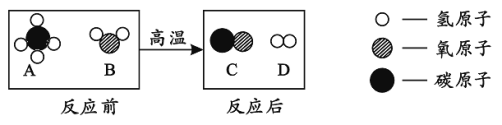
��Ŀ����
����Ŀ��ij������Ʒ�к����������Ȼ��ƣ�Ϊ�˲ⶨ�ô�����̼���Ƶ�����������ȡһ�����ĸô�����Ʒȫ���ܽ���100gˮ�У��ټ����Ȼ�����Һ141g��ǡ����ȫ��Ӧ������Ӧ����ʽΪNa2CO3+CaCl2=CaCO3��+2NaCl�������ˡ������Ƶij�������Ϊ10g��������Һ���Ȼ��Ƶ���������Ϊ5%������㣺
���Ȼ�����Һ�����ʵ���������_____��
�ڴ�����Ʒ��̼���Ƶ���������_____��
���𰸡�7.9% 96.4%
��������
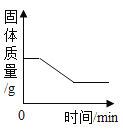
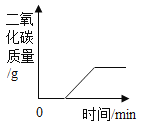
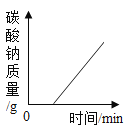
�ٸ����Ȼ��ơ�̼���Ƶ����ʣ��Ȼ��Ʋ����������Ȼ��Ʒ�����Ӧ��̼�������Ȼ�������̼��Ƴ������Ȼ��ƣ��������ɳ���̼��Ƶ������ɼ����Ȼ�����Һ�����ʵ�������������Ȼ�����Һ�����ʵ�����������
�ڽ����������������������Ӧ����Һ���ܼ������������������������Һ���Ȼ��Ƶ������������ԭ��������Ȼ��Ƶ�������������������Ʒ��̼���Ƶ�����������
����ǡ����ȫ��Ӧʱ�μӷ�Ӧ��̼���Ƶ�����Ϊx���Ȼ�����Һ���Ȼ��Ƶ�����Ϊy�������Ȼ��Ƶ�����Ϊz��
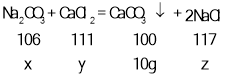
![]() ��ã�x=10.6g��y=11.1g��z=11.7g
��ã�x=10.6g��y=11.1g��z=11.7g
�Ȼ�����Һ�����ʵ���������Ϊ��![]() ��100%��7.9%��
��100%��7.9%��
���������֪����Һ��ˮ������Ϊ��100g+��141g��11.1g��=229.9g������Һ���Ȼ��Ƶ�����Ϊ��
![]() =12.1g
=12.1g
������Ʒ���Ȼ��Ƶ�����Ϊ��12.1g��11.7g=0.4g
������Ʒ��̼���Ƶ���������Ϊ��![]() ��100%��96.4%
��100%��96.4%
�𣺢��Ȼ�����Һ�����ʵ���������Ϊ7.9%���ڴ�����Ʒ��̼���Ƶ���������Ϊ96.4%��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ�����ִ������У�����Խ��Խע����Ԫ�ص���ȡ����Ԫ�ض����彡����������Ҫ�����ã��±���ij���г����۵�һ�����ӵ�ʳ������װ���ϵIJ���˵����
���� | �Ȼ��ơ�����أ�KIO3�� |
������ | ��20mg��30mg��/kg |
������ | 18���� |
ʳ�÷��� | ��ʱ������ |
���淽�� | �ܹ⡢���ȡ��۷䡢���� |
��ش��������⣺
��1����ʳ�÷���������ָ�Ͽ��Ʋ����أ�KIO3���Ļ�ѧ����֮һ��_____��
��2���������أ�KIO3���У���Ԫ�ء���Ԫ�ء���Ԫ�ص�������_____��
��3���������أ�KIO3���У���Ԫ�ص����������Ƕ��٣�_____��
����Ŀ����ȥ���������л��е�����������ѡ�õ��Լ�������ȷ���ǣ� ��
ѡ�� | ����������Ϊ���ʣ� | ѡ�õ��Լ� |
A |
| �������͵�����������Һ |
B |
| ����������ͭ��ĩ |
C |
| ���ȵ����� |
D |
| �������͵�����������Һ |
A.AB.BC.CD.D