题目内容
(2002?云南)过氧化钠(Na2O2)是一种淡黄色粉末,在通常情况下能跟CO2、H2O、HCl发生反应:2Na2O2+2CO2=2Na2CO3+O2↑,2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+4HCl=4NaCl+2H2O+O2↑;为了验证CO2跟Na2O2反应产生的气体是O2,某同学设计了如图所示的实验装置.
试回答列问题:
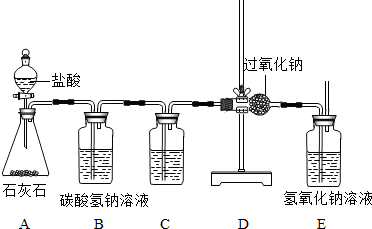
(1)设计B、C装置的目的是净化CO2气体.其中B装置的作用是除去CO2中混有的HCl气体;C装置的作用是
(2)E装置中氢氧化钠溶液的作用是吸收没有反应的CO2,所发生反应的化学方程式是
(3)为了验证CO2和Na2O2反应产生的气体是O2,最后还要进行的操作是
试回答列问题:

(1)设计B、C装置的目的是净化CO2气体.其中B装置的作用是除去CO2中混有的HCl气体;C装置的作用是
除去CO2气体中的水蒸气
除去CO2气体中的水蒸气
,瓶内的液体是浓硫酸(或浓H2SO4)
浓硫酸(或浓H2SO4)
;如果将B、C两瓶内的液体互换,其后果是通向D装置中的CO2气体仍有水蒸气
通向D装置中的CO2气体仍有水蒸气
.(2)E装置中氢氧化钠溶液的作用是吸收没有反应的CO2,所发生反应的化学方程式是
2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O
.(3)为了验证CO2和Na2O2反应产生的气体是O2,最后还要进行的操作是
将带火星的木条靠近E装置中导气管的出口处
将带火星的木条靠近E装置中导气管的出口处
;观察到的现象是木条复燃
木条复燃
是氧气
是氧气
.分析:本题包含了二氧化碳的制取装置,同时也包含了气体的除杂方法、检验方法和干燥方法,本题研究了过氧化钠与二氧化碳反应的性质,检验生成物时用到了氧气的检验方法,氧气是用带火星的木条检验.二氧化碳是用澄清的石灰水检验,用氢氧化钠溶液吸收,用浓硫酸干燥.通过已知条件可知,B、C装置的目的是净化CO2气体,C装置的作用是干燥作用,如果将B、C两瓶内的液体互换,就起不到干燥作用了.E装置中氢氧化钠溶液与二氧化碳反应生成碳酸钠和水,E装置中,最后还要进行的操作是:检验生成物中有氧气.
解答:解:(1)设计B、C装置的目的是净化CO2气体,二氧化碳是用澄清的石灰水检验,用氢氧化钠溶液吸收,用浓硫酸干燥.如果将B、C两瓶内的液体互换,二氧化碳有湿了,就起不到干燥作用了.故答案为:除去CO2气体中的水蒸气;浓硫酸(或浓H2SO4); 通向D装置中的CO2气体仍有水蒸气.
(2)氢氧化钠溶液与二氧化碳反应生成碳酸钠和水,配平即可.故答案为:2NaOH+CO2=Na2CO3+H2O.
(3)用带火星的木条伸入集气瓶中,木条复燃,证明是氧气.故答案为:将带火星的木条靠近E装置中导气管的出口处;木条复燃;是氧气.
(2)氢氧化钠溶液与二氧化碳反应生成碳酸钠和水,配平即可.故答案为:2NaOH+CO2=Na2CO3+H2O.
(3)用带火星的木条伸入集气瓶中,木条复燃,证明是氧气.故答案为:将带火星的木条靠近E装置中导气管的出口处;木条复燃;是氧气.
点评:本考点属于实验探究题,考查了过氧化钠的有关性质和变化的规律,还考查了反应装置、除杂装置和干燥装置等,综合性比较强.既有实验过程的探究,又有结论的探究.首先提出问题、作出假设,然后设计实验方案、进行实验,最后得出正确的结论,要注意实验现象的描述和化学方程式的配平.本考点主要出现在实验题中.

练习册系列答案
相关题目