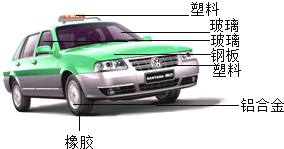
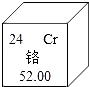
题目内容
【题目】我国海洋资源极为丰富,某镁冶炼厂利用海水提取镁,其主要流程为: ![]()
(1)反应②的化学方程式为;
(2)现有含MgCl2 0.475%的海水200t,经上述反应后可制得镁t.(假设上述各步反应中,镁元素一共损失10%)
【答案】
(1)2HCl+Mg(OH)2═MgCl2+2H2O
(2)0.216
【解析】解:(1)氢氧化镁和盐酸反应生成了氯化镁和水,可以据此写出该反应的化学方程式为:2HCl+Mg(OH)2═MgCl2+2H2O;(2)200t海水中含有的氯化镁的质量为:200t×0.475%=0.95t,95t氯化镁中含有的镁元素的质量为:0.95t× ![]() ×100%=0.24t,所以可以制得镁的质量为:0.24t×(1﹣10%)=0.216t所以答案是:(1)2HCl+Mg(OH)2═MgCl2+2H2O;(2)0.216.
×100%=0.24t,所以可以制得镁的质量为:0.24t×(1﹣10%)=0.216t所以答案是:(1)2HCl+Mg(OH)2═MgCl2+2H2O;(2)0.216.

练习册系列答案
相关题目