题目内容
【题目】为探究金属的化学性质,进行下图所示实验. 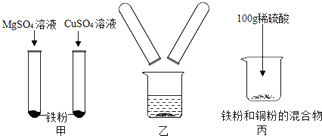
(1)甲图中发生反应的化学方程式为;Mg、Cu、Fe的金属活动性由强到弱的顺序是 .
(2)如乙图所示,将甲图实验反应后的物质倒入烧杯中,发现烧杯内的红色固体明显增多,充分反应后过滤.有关说法正确的是 .
A.滤液中一定没有CuSO4
B.滤渣中一定没有Mg、Fe
C.滤液中一定含有MgSO4、FeSO4
D.滤渣中一定含有Cu,可能含有Fe
(3)在丙图所示的实验过程中有关物质的质量随反应时间的变化关系如下图,正确的是(填序号). 
【答案】
(1)CuSO4+Fe=Cu+FeSO4;Mg>Fe>Cu
(2)CD
(3)A、D
【解析】解:(1)反应物是铁和硫酸铜,生成物是铜和硫酸亚铁,已经平了改成等号即可,故其化学方程式为CuSO4+Fe=Cu+FeSO4;铁能与硫酸铜反应说明铁排在了铜的前面,铁不能与硫酸镁反应,说明铁排在了镁的后面,故Mg、Cu、Fe的金属活动性由强到弱的顺序是Mg>Fe>Cu;(2)将实验一后甲中试管内的物质倒入乙图烧杯中,发现烧杯内的红色固体明显增多,说明铁在置换铜,一段时间后过滤.因为Mg、Cu、Fe的金属活动性由强到弱的顺序是Mg>Fe>Cu,故滤液中一定含有MgSO4、FeSO4;滤渣中一定含有的物质是铜,可能有的物质就是铁,铁可能反应完了,也可能没反应完有剩余;
故选CD;(3)根据金属的活动性顺序可知Fe>H>Cu,铁与稀硫酸反应生成硫酸亚铁和氢气,而铜与稀硫酸不反应;随着反应的进行,氢气的质量增加,当铁完全反应后,氢气的质量不再改变;随着铁的反应,金属混合物的质量不断减小,当铁完全反应后,剩余固体是铜,质量不再减小.所以AD正确.
所以答案是:(1)CuSO4+Fe=Cu+FeSO4;Mg>Fe>Cu合理均可;(2)C、D;(3)A、D.
【考点精析】认真审题,首先需要了解金属材料的选择依据(黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案