题目内容
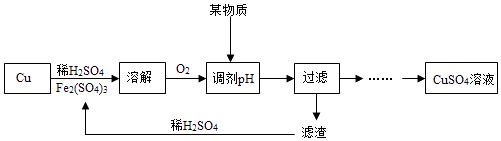
【题目】欲除去氮气中的少量氧气、水蒸气、一氧化碳、二氧化碳等杂质,可使混合气体通过下列物质:(1)澄清的石灰水;(2)灼热的氧化铜;(3)灼热的铜;(4)浓硫酸。顺序正确的是( )
A.(1)(2)(3)(4)
B.(3)(2)(1)(4)
C.(4)(2)(1)(3)
D.(2)(4)(3)(1)
【答案】B
【解析】
除去水蒸气要放在最后除去,用石灰水吸收二氧化碳,除二氧化碳要放在除一氧化碳之后,因为用氧化铜除去一氧化碳和氢气,又生成二氧化碳和水蒸气,除去水蒸气用浓硫酸。因此顺序是先通过灼热的氧化铜除去一氧化碳和氢气,再通过石灰水除去二氧化碳,然后通过浓硫酸除去水蒸气,顺序是(3)(2)(1)(4)。
故选B。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目