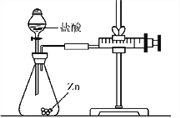
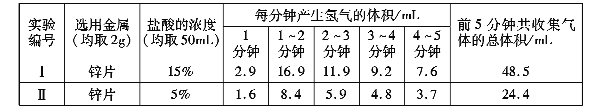
题目内容
【题目】下图是初中化学中常见物质间的转化关系,其中甲、乙、丙均为非金属单质,A、B、E和丁均为化合物,B和E为能产生温室效应的气体。
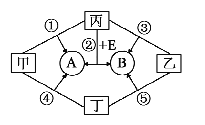
(1)物质甲是____。
(2)写出丙和E反应生成A和B的化学方程式__________
(3)另有一种物质D,已知D和A组成元素相同,若丁是一种 红棕色固体,D在丁做催化剂条件下分解生成A和丙,写 出反应的化学方程式____。
(4)图中发生反应的基本反应类型属于置换反应的是____(填序号)。
【答案】 H2(或氢气) CH4十202点燃CO2十2H2O 2H202 Fe203 2H2O +O2↑ ④⑤
【解析】其中甲、乙、丙均为非金属单质,A、B、E和丁均为化合物,B和E为能产生温室效应的气体,所以丙是氧气,甲是氢气、乙是碳,E是甲烷,B是二氧化碳;甲烷燃烧生成二氧化碳和水,方程式为:CH4十202![]() CO2十2H2O A为水;氢气燃烧生成水,碳燃烧生成二氧化碳;红色固体氧化铁和碳在高温下反应生成铁和二氧化碳;和氢气加热条件下生成铁和水,丁是氧化铁;过氧化氢在氧化铁的作用下分解生成水和氧气,反应方程式为:2H202 Fe203 2H2O +O2↑;由一种单质和一种氧化物生成另一种单质和另一种氧化物的反应叫置换反应; 故④⑤ 是置换反应。
CO2十2H2O A为水;氢气燃烧生成水,碳燃烧生成二氧化碳;红色固体氧化铁和碳在高温下反应生成铁和二氧化碳;和氢气加热条件下生成铁和水,丁是氧化铁;过氧化氢在氧化铁的作用下分解生成水和氧气,反应方程式为:2H202 Fe203 2H2O +O2↑;由一种单质和一种氧化物生成另一种单质和另一种氧化物的反应叫置换反应; 故④⑤ 是置换反应。

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目