题目内容
【题目】为测定空气中氧气的含量,小华和小强同学分别设计如下方案:
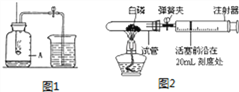
小华:采用图1装置进行实验.(燃烧匙中药品为红磷)
小强:(如图2)用实际容积为40mL的试管作反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管口,通过导管与润滑性很好的针筒注射器组成如图的实验装置。假设此实验能按照小强的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计。
请回答下列问题:
(1)待燃烧停止,白烟消失并冷却后,打开止水夹,观察到进入集气瓶中水的体积不到总容积的1/5,你认为其原因可能是___________、________________。(写2点)
(2)如将燃烧匙中红磷换成碳粉,实验能否成功?说明理由。__________。
(3)用小强设计完成实验时:实验前,若先夹紧弹簧夹,用酒精灯加热红磷,燃烧结束,等到试管冷却后再松开弹簧夹。可观察到的现象为_______________。
(4)图2的设计操作与图1比较,其优点是_____________。
【答案】 红磷量不足 装置气密性不好 不能,碳粉燃烧会产生二氧化碳气体杂质 活塞向前移动,最后停在12mL处 操作更简单,实验结果误差更小
【解析】(1)测量结果偏低的原因可能是红磷量不足;装置气密性不好;(2)碳燃烧后生成二氧化碳气体,填充了耗掉氧气的体积,故不能;(3)氧气占空气体积的五分之一,试管的容积为40ml,则氧气的体积为8ml,故活塞向前移动,最后停在12mL处;(4)图2与图1比较操作更简单,污染小,实验结果误差更小。

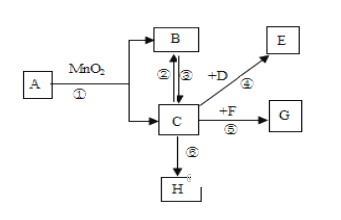
【题目】除去下列物质中的少量杂质(括号内为杂质)所用除去杂质的方法正确的是( )
选项 | 待提纯的物质 | 除去杂质的方法 |
A | KCl(MnO2) | 加水溶解、过滤、洗涤、干燥 |
B | NaNO3(Na2SO4) | 加水溶解、加过量硝酸钡溶液、过滤、蒸发 |
C | H2O(悬浮物) | 加活性炭、吸附、沉降 |
D | O2(水蒸气) | 将混合气体通过盛有足量浓硫酸的洗气瓶 |