题目内容
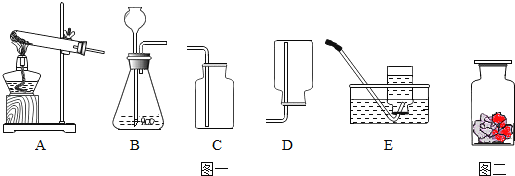
【题目】某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从如图中选择装置进行了氧气的制备实验.

(1)写出仪器名称:a ,b .
(2)因为氧气不易溶于水,故可以采用 装置收集(填字母序号,下同);因为氧气的密度比空气大,故可以选用 装置收集.
(3)实验室用二氧化锰与过氧化氢制取氧气,选择的发生装置是 ,若要收集一瓶较纯净的氧气,选择的收集装置是 ,该反应的文字表达式为 .
(4)实验室用高锰酸钾制取氧气可选用的发生装置是 .为了防止高锰酸钾粉末进入导管,该装置还必须作出的一项改正是 ,该反应的文字表达式为 .
(5)该实验中有很多注意事项,如试管口要略向下倾斜;加热之前要先预热…请你另补写一条注意事项: .
(6)李时同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,李明同学发现排水法收集到的O2大于理论产量.针对这一现象,同学们进行了如下探究:
[提出猜想]猜想Ⅰ:反应生成的MnO2分解放出O2.
猜想Ⅱ:反应生成的K2MnO4分解放出O2.
猜想Ⅲ:反应生成的K2MnO4和MnO2分解都放出O2.
[实验验证]同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想 错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ是正确的结论.该组同学选择的实验方法是 .
[拓展延伸]实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快,请说明KMnO4在KClO3的分解反应 是否作催化剂,为什么? .
【答案】(1)a试管;b集气瓶;(2)E;C;(3)B;E;过氧化氢![]() 水+氧气;(4)A;在试管口放一团棉花;高锰酸钾
水+氧气;(4)A;在试管口放一团棉花;高锰酸钾![]() 锰酸钾+二氧化锰+氧气;(5)高锰酸钾受热分解制氧气实验完毕,先将导管移出水槽再停止加热;(6)【实验验证】Ⅰ和Ⅲ、把带火星的木条伸入试管中,木条复燃;【拓展延伸】高锰酸钾不是催化剂.因为高锰酸钾在反应后的质量和性质发生了变化.
锰酸钾+二氧化锰+氧气;(5)高锰酸钾受热分解制氧气实验完毕,先将导管移出水槽再停止加热;(6)【实验验证】Ⅰ和Ⅲ、把带火星的木条伸入试管中,木条复燃;【拓展延伸】高锰酸钾不是催化剂.因为高锰酸钾在反应后的质量和性质发生了变化.
【解析】(1)根据实验室常用仪器可知:a试管;b集气瓶;
(2)因为氧气不易溶于水,故可以采用排水法收集;因为氧气的密度比空气大,故可以选用向上排空气法收集;
(3)实验室用二氧化锰与过氧化氢制取氧气,属于固液常温型,选择的发生装置是B;要收集一瓶较纯净的氧气,选择的收集装置是B;该反应的文字表达式为:过氧化氢![]() 水+氧气;
水+氧气;
(4)实验室用高锰酸钾制取氧气需加热,可选用的发生装置是A;为了防止高锰酸钾粉末进入导管,该装置还必须作出的一项改正是在试管口放一团棉花,该反应的文字表达式为:高锰酸钾![]() 锰酸钾+二氧化锰+氧气;
锰酸钾+二氧化锰+氧气;
(5)高锰酸钾受热分解制氧气实验完毕,先将导管移出水槽再停止加热;
(6)【实验验证】
在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,说明250℃时,二氧化锰不能分解,所以猜想Ⅰ和Ⅲ错误;取高锰酸钾在250℃条件下加热,把带火星的木条伸入试管中,木条复燃,说明猜想Ⅱ正确.故填:Ⅰ和Ⅲ;把带火星的木条伸入试管中,木条复燃.
【拓展延伸】
【实验反思】氯酸钾固体加热制取氧气的反应速率很慢,但如果将高锰酸钾固体与氯酸钾固体混合加热,则氯酸钾分解速率大大加快,原因是高锰酸钾加热分解为锰酸钾、二氧化锰、氧气,二氧化锰可以加快氯酸钾的分解,但高锰酸钾不是催化剂.因为高锰酸钾在反应后的质量和性质发生了变化.

 名师点拨卷系列答案
名师点拨卷系列答案