题目内容
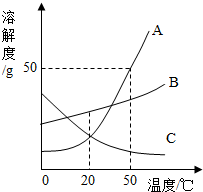 (2013?泰安)如图是A、B、C三种固体物质的溶解度曲线.下列分析不正确的是( )
(2013?泰安)如图是A、B、C三种固体物质的溶解度曲线.下列分析不正确的是( )分析:A、据溶解度曲线可以比较同一温度下物质的溶解度大小;
B、据50℃时A的溶解度分析解答;
C、据C的溶解度随温度变化趋势及饱和溶液变为不饱和溶液的方法分析解答;
D、据三种物质的溶解度随温度变化及饱和溶液中溶质的质量分数计算式分析解答.
B、据50℃时A的溶解度分析解答;
C、据C的溶解度随温度变化趋势及饱和溶液变为不饱和溶液的方法分析解答;
D、据三种物质的溶解度随温度变化及饱和溶液中溶质的质量分数计算式分析解答.
解答:解:A、50℃时,三种物质的溶解度由大到小的顺序是A>B>C,正确;
B、50℃时A的溶解度是50g,所以把50 g A放入50 g水中最多溶解25g,能形成75 g A的饱和溶液,正确;
C、C的溶解度随温度的降低而增大,所以将C的饱和溶液变为不饱和溶液,可采用降温的方法,正确;
D、AB的溶解度随温度降低而减小,C的溶解度随温度的降低而增大,所以分别将三种物质的饱和溶液从50℃将至20℃时,AB析出晶体,依然是饱和溶液,此时B的溶解度大于A,C变为不饱和溶液,溶质的质量分数与降温前相等,20℃时A的溶解度与C的溶解度相等,根据饱和溶液中溶质的质量分数的计算式
×100%可知:降温后所得溶液溶质质量分数大小关系是B>A>C,故错误;
故选D.
B、50℃时A的溶解度是50g,所以把50 g A放入50 g水中最多溶解25g,能形成75 g A的饱和溶液,正确;
C、C的溶解度随温度的降低而增大,所以将C的饱和溶液变为不饱和溶液,可采用降温的方法,正确;
D、AB的溶解度随温度降低而减小,C的溶解度随温度的降低而增大,所以分别将三种物质的饱和溶液从50℃将至20℃时,AB析出晶体,依然是饱和溶液,此时B的溶解度大于A,C变为不饱和溶液,溶质的质量分数与降温前相等,20℃时A的溶解度与C的溶解度相等,根据饱和溶液中溶质的质量分数的计算式
| 溶解度 |
| 溶解度+100g |
故选D.
点评:掌握溶解度的概念、溶解度曲线的意义及溶质的质量分数计算方法,并能结合选项灵活分析解答问题.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目