题目内容
(1)通过一年的化学学习,你已经掌握了实验室制取气体的有关规律,请你结合下列装置图回答问题: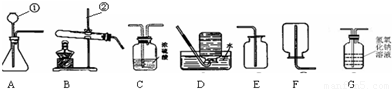
a.写出下列仪器的名称① ;② .
b.晓杰同学想用高锰酸钾制取氧气,应选用的发生装置是 (填序号,下同),写出该反应的化学方程式是 .
c.晓海经查阅资料,得知乙炔(C2H2)气体可用水和CaC2固体反应制取.写出该反应的化学方程式为 .在制取的乙炔气体中常含有酸性杂质气体CO2和H2S,为除去杂物,得到纯净干燥的乙炔气体,装置连接顺序为:A→ → →F.
(2)过氧化钠是化学中常见的一种药品,它是浅黄白色颗粒粉末.在空气中吸收水分和二氧化碳.易溶于水,与水中能发生反应生成氢氧化钠和过氧化氢,方程式:Na2O2+2H2O=2NaOH+H2O2,过氧化氢又能分解放出氧气.
a.区分水和过氧化氢的实验方法是: ,发生的反应方程式是: .
b.某同学为了证明过氧化钠加入水中生成了氢氧化钠,在生成的溶液中滴加了几滴无色酚酞试液,观察到的现象是溶液先变红后褪为无色,请你对此现象进行探究.
提出问题:什么导致溶液先变红再褪色?
猜想与假设:
猜想1:甲同学“可能是无色酚酞溶液变质导致溶液褪色”;
猜想2:乙同学“可能是生成的过氧化氢使溶液褪色”.
实验与结论:
①甲同学提出的猜想,立即遭到其他同学的反对,因为 ;
②为了验证自己的猜想,乙同学设计了以下方案并实验验证:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量稀氢氧化钠溶液于试管中,滴加1-2滴酚酞试液,变红后 观察现象 | 溶液依然为红色 |
猜想3: .
方案3:
| 实验步骤 | 实验现象 | 实验结论 |
【答案】分析:(1)a、直接写出仪器的名称;
b、根据药品的状态和反应所需的条件选择发生装置,高锰酸钾分解产生氧气、二氧化锰和锰酸钾,可以据此解答;
c、根据反应物和生成物及化学方程式的书写步骤可写出方程式;乙炔中含有酸性气体可通过氢氧化钠碱溶液吸收,乙炔气中的水可通过浓硫酸进行干燥,可以据此解答该题;
(2)a、过氧化氢能够在二氧化锰的催化下分解产生氧气,而水不能可以据此解答;
b、①根据开始溶液由无色到红色再到无色,可以判断无色酚酞没有变质,可以据此解答;
②根据过氧化钠和水反应生成的物质可以验证过氧化氢是否能够是溶液褪色,可以据此解答;
猜想3:可以考虑氢氧化钠溶液的浓度过大等相关的因素来完成解答.
解答:解:(1)a、题中所给仪器的名称为:①长颈漏斗;②铁架台;
b、高锰酸钾是固体,反应条件是加热,发生装置应选B,该反应的化学方程式为:2KMnO4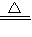 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
c、实验室中制取乙炔的反应的化学方程式为:CaC2+2H20═Ca(OH)2+C2H2↑;乙炔中含有酸性气体可通过氢氧化钠溶液吸收,乙炔气中的水可通过浓硫酸进行干燥.
(2)a、过氧化氢能够在二氧化锰的催化下分解产生氧气和水,而水不能,所以可以分别取等量的两种无色液体于两支试管中,分别加入等质量二氧化锰观察现象即可,若产生了气体,则是过氧化氢,反之为水;
b、①根据开始溶液由无色到红色再到无色,如果酚酞变质,则一开始溶液也不会变红,所以可以判断无色酚酞没有变质;
②根据过氧化钠和水反应生成的了氢氧化钠和过氧化氢,所以在这里要排除过氧化氢的干扰,可以向变红了的氢氧化钠溶液中加入过氧化氢观察现象,若红色不消失,则说明乙同学的猜想正确;
讨论交流:
猜想3:可以考虑氢氧化钠溶液的浓度过大等相关的因素,所以可以取少量原溶液于试管中,加入适量水,观察现象
,若红色消失则说明氢氧化钠的浓度与颜色消失有关,反之则无关.
故答案为:(1)a.①长颈漏斗; ②铁架台.
b.B,方程式2KMnO4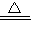 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
c.2H2O+CaC2═C2H2↑+Ca(OH)2; A→G→C→F
(2)a.加二氧化锰粉末,观察是否有气泡放出;2H2O2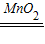 2H2O+O2↑
2H2O+O2↑
b.①若酚酞溶液变质,则溶液不会变红
②
猜想3
点评:本题综合性比较强,既有实验过程的探究,又有结论的探究,探究问题的一般思路:首先提出问题、作出假设,然后设计实验方案、进行实验,最后得出正确的结论,并对设计的方案进行了拓展.本考点是中考的重要内容之一,主要出现在实验题中.
b、根据药品的状态和反应所需的条件选择发生装置,高锰酸钾分解产生氧气、二氧化锰和锰酸钾,可以据此解答;
c、根据反应物和生成物及化学方程式的书写步骤可写出方程式;乙炔中含有酸性气体可通过氢氧化钠碱溶液吸收,乙炔气中的水可通过浓硫酸进行干燥,可以据此解答该题;
(2)a、过氧化氢能够在二氧化锰的催化下分解产生氧气,而水不能可以据此解答;
b、①根据开始溶液由无色到红色再到无色,可以判断无色酚酞没有变质,可以据此解答;
②根据过氧化钠和水反应生成的物质可以验证过氧化氢是否能够是溶液褪色,可以据此解答;
猜想3:可以考虑氢氧化钠溶液的浓度过大等相关的因素来完成解答.
解答:解:(1)a、题中所给仪器的名称为:①长颈漏斗;②铁架台;
b、高锰酸钾是固体,反应条件是加热,发生装置应选B,该反应的化学方程式为:2KMnO4
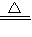 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;c、实验室中制取乙炔的反应的化学方程式为:CaC2+2H20═Ca(OH)2+C2H2↑;乙炔中含有酸性气体可通过氢氧化钠溶液吸收,乙炔气中的水可通过浓硫酸进行干燥.
(2)a、过氧化氢能够在二氧化锰的催化下分解产生氧气和水,而水不能,所以可以分别取等量的两种无色液体于两支试管中,分别加入等质量二氧化锰观察现象即可,若产生了气体,则是过氧化氢,反之为水;
b、①根据开始溶液由无色到红色再到无色,如果酚酞变质,则一开始溶液也不会变红,所以可以判断无色酚酞没有变质;
②根据过氧化钠和水反应生成的了氢氧化钠和过氧化氢,所以在这里要排除过氧化氢的干扰,可以向变红了的氢氧化钠溶液中加入过氧化氢观察现象,若红色不消失,则说明乙同学的猜想正确;
讨论交流:
猜想3:可以考虑氢氧化钠溶液的浓度过大等相关的因素,所以可以取少量原溶液于试管中,加入适量水,观察现象
,若红色消失则说明氢氧化钠的浓度与颜色消失有关,反之则无关.
故答案为:(1)a.①长颈漏斗; ②铁架台.
b.B,方程式2KMnO4
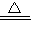 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑c.2H2O+CaC2═C2H2↑+Ca(OH)2; A→G→C→F
(2)a.加二氧化锰粉末,观察是否有气泡放出;2H2O2
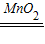 2H2O+O2↑
2H2O+O2↑b.①若酚酞溶液变质,则溶液不会变红
②
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量稀氢氧化钠溶液于试管中,滴加1-2滴酚酞试液,变红后 加入过氧化氢溶液 多余的空观察现象 | 溶液依然为红色 | 不是生成的过氧化氢使溶液褪色 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量原溶液于试管中,加入适量水,观察现象 | (1)变回红色 (2)依然无色 | (1)氢氧化钠溶液浓度过大导致溶液颜色褪去 (2)溶液颜色褪去与氢氧化钠溶液浓度无关 |
点评:本题综合性比较强,既有实验过程的探究,又有结论的探究,探究问题的一般思路:首先提出问题、作出假设,然后设计实验方案、进行实验,最后得出正确的结论,并对设计的方案进行了拓展.本考点是中考的重要内容之一,主要出现在实验题中.

练习册系列答案
相关题目
(1)通过一年的化学学习,你已经掌握了实验室制取气体的有关规律,请你结合下列装置图回答问题: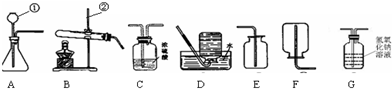
a.写出下列仪器的名称①______;②______.
b.晓杰同学想用高锰酸钾制取氧气,应选用的发生装置是______ (填序号,下同),写出该反应的化学方程式是______.
c.晓海经查阅资料,得知乙炔(C2H2)气体可用水和CaC2固体反应制取.写出该反应的化学方程式为______.在制取的乙炔气体中常含有酸性杂质气体CO2和H2S,为除去杂物,得到纯净干燥的乙炔气体,装置连接顺序为:A→______→______→F.
(2)过氧化钠是化学中常见的一种药品,它是浅黄白色颗粒粉末.在空气中吸收水分和二氧化碳.易溶于水,与水中能发生反应生成氢氧化钠和过氧化氢,方程式:Na2O2+2H2O=2NaOH+H2O2,过氧化氢又能分解放出氧气.
a.区分水和过氧化氢的实验方法是:______,发生的反应方程式是:______.
b.某同学为了证明过氧化钠加入水中生成了氢氧化钠,在生成的溶液中滴加了几滴无色酚酞试液,观察到的现象是溶液先变红后褪为无色,请你对此现象进行探究.
提出问题:什么导致溶液先变红再褪色?
猜想与假设:
猜想1:甲同学“可能是无色酚酞溶液变质导致溶液褪色”;
猜想2:乙同学“可能是生成的过氧化氢使溶液褪色”.
实验与结论:
①甲同学提出的猜想,立即遭到其他同学的反对,因为______;
②为了验证自己的猜想,乙同学设计了以下方案并实验验证:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量稀氢氧化钠溶液于试管中,滴加1-2滴酚酞试液,变红后______ 观察现象 | 溶液依然为红色 | ______ |
猜想3:______.
方案3:
| 实验步骤 | 实验现象 | 实验结论 |
| ______ | ______ | ______ |
