题目内容
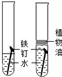
暖宝宝是一种防寒用品,如图所示。暖宝宝中的主要成分有哪些?发热的原因是什么?

(1)小明探究:暖宝宝中的主要成分是什么?
剪开内包装袋,倒出其中的粉末,发现呈黑色。
【提出猜想】该黑色粉末可能含有炭粉、铁粉、二氧化锰、氧化铜、四氧化三铁中的一种或几种。
【初步验证】将磁铁靠近黑色粉末,部分被吸引。
【查阅资料】四氧化三铁具有磁性,能被磁铁吸引;炭粉、二氧化锰不与稀硫酸反应;氧化铜与稀硫酸反应后溶液呈蓝色。
【得出结论】该黑色粉末可能含有(写物质的名称) 。
【进行实验】
由实验①可知,该黑色粉末中肯定含_____________,肯定不含______________。
由实验②可知,该黑色粉末肯定含 。
(2)小明思考:暖宝宝为什么会发热?
【查阅资料】暖宝宝中的铁粉在空气中发生了缓慢氧化,进而放出热量。由此可见,
人们可以利用化学反应放出的能量,请再举一例:___________________。
(3)人们利用化学反应还可以_______________________。
(4)课外小组的同学研究的课题是测定贝壳中碳酸钙的质量分数,他们取25g贝壳粉碎后放入烧杯中,向杯中倒入稀盐酸,当倒入100g稀盐酸后发现不再产生气泡,并测得烧杯内固体和液体总质量为120.6g (杂质不反应)。求贝壳中碳酸钙的质量分数。

(1)小明探究:暖宝宝中的主要成分是什么?
剪开内包装袋,倒出其中的粉末,发现呈黑色。
【提出猜想】该黑色粉末可能含有炭粉、铁粉、二氧化锰、氧化铜、四氧化三铁中的一种或几种。
【初步验证】将磁铁靠近黑色粉末,部分被吸引。
【查阅资料】四氧化三铁具有磁性,能被磁铁吸引;炭粉、二氧化锰不与稀硫酸反应;氧化铜与稀硫酸反应后溶液呈蓝色。
【得出结论】该黑色粉末可能含有(写物质的名称) 。
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取黑色粉末加足量稀硫酸 | 固体部分溶解,有气泡产生,溶液无蓝色 |
| ② | 取实验①的残渣灼烧,将内壁涂 有澄清石灰水的小烧杯罩在上方 | 澄清石灰水变浑浊 |
由实验①可知,该黑色粉末中肯定含_____________,肯定不含______________。
由实验②可知,该黑色粉末肯定含 。
(2)小明思考:暖宝宝为什么会发热?
【查阅资料】暖宝宝中的铁粉在空气中发生了缓慢氧化,进而放出热量。由此可见,
人们可以利用化学反应放出的能量,请再举一例:___________________。
(3)人们利用化学反应还可以_______________________。
(4)课外小组的同学研究的课题是测定贝壳中碳酸钙的质量分数,他们取25g贝壳粉碎后放入烧杯中,向杯中倒入稀盐酸,当倒入100g稀盐酸后发现不再产生气泡,并测得烧杯内固体和液体总质量为120.6g (杂质不反应)。求贝壳中碳酸钙的质量分数。
(1)铁和四氧化三铁; 铁; 氧化铜; 炭粉;
(2)燃烧燃料做饭等(其他合理答案均可)
(3)制造新物质等(其他合理答案均可)
(2)燃烧燃料做饭等(其他合理答案均可)
(3)制造新物质等(其他合理答案均可)
试题分析:(1)由“磁铁靠近黑色粉末,部分被吸引”,根据资料可知,黑色粉末可能是铁和四氧化三铁;取黑色粉末加足量稀硫酸,有气泡产生说明含有铁,溶液无蓝色说明不含氧化铜;澄清石灰水变浑浊说明燃烧产生了二氧化碳即说明黑色粉末中含有炭粉;
(2)人们可以利用化学反应放出的能量的例子有:燃烧燃料做饭、拆除楼房等
(3)化学变化是生成新物质的变化,可用于制造新物质等
(4)根据题意,石灰石与稀盐酸反应的化学方程式为:
CaCO3+2HCl ="=" CaCl2+H2O+CO2↑
依据质量守恒定律化学反应前后物质的总质量不变,则减少的质量为反应生成的二氧化碳的质量,即生成二氧化碳的质量为:(25g+100g)-120.6g =4.4g ;利用化学方程式中碳酸钙与二氧化碳的质量比,结合二氧化碳的质量,可求出样品中碳酸钙的质量。
解:生成二氧化碳的质量为:(25g+100g)-120.6g =4.4g
设25g贝壳中含CaCO3的质量为X
CaCO3+ 2HC1 = CaCl2 + CO2 ↑ + H2O
100 44
X 4.4g
100:44 = X: 4.4g
X = 10g
贝壳中碳酸钙的质量分数为:10g/25g×100% =40%

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
 CaO+CO2↑),为了确定白色固体的成分,对其可能的组成进行探究,请你完成下表.
CaO+CO2↑),为了确定白色固体的成分,对其可能的组成进行探究,请你完成下表.

 .
.