题目内容
【题目】鸡蛋壳的主要成分是碳酸钙.小明同学为了测定鸡蛋壳中碳酸钙的质量分数,分别设计了如下实验并进行计算.将鸡蛋壳洗净、干燥并捣碎后放入锥形瓶里,加入足量的稀盐酸充分反应(假设其他杂质不与盐酸反应)
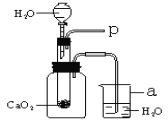
测得相关数据如图所示:

【数据处理】
(1)反应生成二氧化碳的质量为 g.
(2)请帮小明计算鸡蛋壳中碳酸钙的质量分数,并写出计算过程:
【答案】(1)4.4g(2)80%
【解析】
试题分析:根据质量守恒定律可以知道:反应生成二氧化碳的质量为=12.5克+40.5克-48.6克=4.4克。
解:设鸡蛋壳中碳酸钙的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
10044
x4.4g
列比例式得:100:X=44:4.4克求得X=10克
鸡蛋壳中碳酸钙的质量分数为:10/12.5×100%=80%
答:鸡蛋壳中碳酸钙的质量分数为80%

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】.化学学习让我们有很多收获。下列归纳和总结完全正确的一组是
A.对化学资源的认识 | B.对人物贡献的认识 |
①可用塑料来代替部分铜制造汽车零部件 ②稀土是不可再生的重要战略资源,应合 理利用和保护 | ①拉瓦锡:定量法测定空气的组成 ②张青莲:电解水法测定水的组成 |
C.对物质俗称的认识 | D.对安全的认识 |
①烧碱、纯碱都是氢氧化钠 ②熟石灰、消石灰都是氢氧化钙 | ①点燃可燃性气体前一定要验纯 ②含有亚硝酸钠的工业用盐可以食用 |