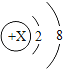题目内容
【题目】为测定锌铜合金中锌的含量,取该合金放入如图盛有稀硫酸的锥形瓶中.多次实验后,取平均值所得数据如表:
反应前 | 充分反应后装置及反应剩余物质质量 | |
装置和足量的稀硫酸质量 | 锌铜合金质量 | |
342.10g | 16.00g | 357.70g |
 若不考虑干燥剂吸收空气中的水蒸气,计算:
若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量 .
(2)该合金中锌的质量分数.
【答案】
(1)0.4g
(2)
解:设锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑,
65 2
x 0.4g
![]() =
= ![]() ,
,
x=13g,
该合金中锌的质量分数为: ![]() ×100%=81.25%,
×100%=81.25%,
答:该合金中锌的质量分数为81.25%.
【解析】解:(1)反应生成氢气的质量为:342.10g+16.00g﹣357.70g=0.4g,故填:0.4g.
铜不能和稀硫酸反应,锌和稀硫酸反应生成硫酸锌和氢气,反应前后的质量差即为反应生成氢气的质量,根据氢气的质量可以计算锌的质量,进一步可以计算锌的质量分数.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目