题目内容
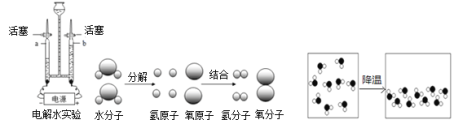
【题目】下图中A~E是初中化学常见的物质,已知A和E都有可燃性,C是能使澄清石灰水变浑浊的气体,D是实验室常见的一种液体。请分析回答:
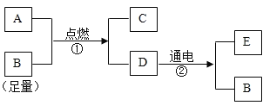
(1)写出物质的化学式:C ;D ;E 。
(2)反应②的符号表达式为 。
(3)根据图示可推出A中一定含有 元素和 元素,可能含有 元素。
【答案】(1)CO2 H2O H2 (2) H2O ![]() H2+O2
H2+O2
(3)碳(C)和 氢(H) 氧(O )
【解析】
试题分析:推断题的解答,应抓住一些特征,如:物质的颜色,反应条件(点燃、通电、催化剂等)以及一些特殊的反应现象等;C是能使澄清石灰水变浑浊的气体,可判断为二氧化碳,D是实验室常见的一种液体,并且在通电情况下发生分解反应,故可判断为水,同时生成B,可判断B为氧气,则E为氢气
(1)C为二氧化碳,化学式为:CO2;D为水,化学式为:H2O;E为氢气,化学式为:H2
(2)反应②是水通电分解,符号表达式为:H2O ![]() H2+O2
H2+O2
(3)反应①的文字表达式可表示为:A+氧气 ![]() 水+二氧化碳,根据质量守恒定律:化学反应前后,元素的种类不变,故可推出A中一定含有碳(C)和 氢(H)元素,可能含有氧(O)元素
水+二氧化碳,根据质量守恒定律:化学反应前后,元素的种类不变,故可推出A中一定含有碳(C)和 氢(H)元素,可能含有氧(O)元素

练习册系列答案
相关题目