题目内容
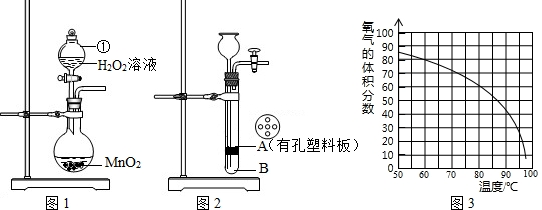
请根据下列装置图,回答有关问题: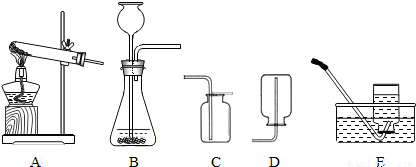
(1)实验室用B、C装置制取二氧化碳的化学方程式为 .
(2)实验室用高锰酸钾制取氧气,可选用的发生装置是 (填字母)
(3)实验室收集氢气可用D或E装置的原因分别是 .
(4)实验室收集二氧化碳时,验满的方法是 .
【答案】分析:(1)实验室用B装置制取二氧化碳是合理的;原因是:凡是固体物质与液体反应且不需要加热就可用此装置.实验室制取二氧化碳用到固体大理石或石灰石与液体稀盐酸反应且不需要加热符合使用此装置,由于二氧化碳气体的密度比空气的大,可用C装置收集.正确书写制取二氧化碳气体的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)实验室用高锰酸钾制取氧气,可选用的发生装置是 A,是合理的.原因是:凡是固体物质加热分解制取气体就可用此装置,实验室用的高锰酸钾是固体物质且需加热分解制氧气符合使用此装置.
(3)凡是密度比空气小且无毒的气体就可用向下排空气法,凡是难溶于水且不与水反应的气体就可用排水法收集;氢气的密度比空气小;难溶于水且不与水反应就可使用D或E装置.
(4)由于二氧化碳既不燃烧也不能支持燃烧且密度比空气大,所以验满二氧化碳气体的最简方法是:将燃着的木条放在集气瓶口,观察到木条熄灭.
解答:解:(1)实验室用B装置制取二氧化碳是合理的;原因是:凡是固体物质与液体反应且不需要加热就可用此装置.实验室制取二氧化碳用到固体大理石或石灰石与液体稀盐酸反应且不需要加热符合使用此装置,由于二氧化碳气体的密度比空气的大,可用C装置收集.因此正确书写制取二氧化碳气体的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)实验室用高锰酸钾制取氧气,选用发生装置 A 是合理的.原因是:凡是固体物质加热分解制取气体就可用此装置,实验室用的高锰酸钾是固体物质且需加热分解制氧气符合使用此装置.因此选用的发生装置是 A.
(3)凡是密度比空气小且无毒的气体就可用向下排空气法,凡是难溶于水且不与水反应的气体就可用排水法收集;氢气的密度比空气小;难溶于水且不与水反应就可使用D或E装置.因此此空应填:氢气的密度比空气小;难溶于水且不与水反应.
(4)由于二氧化碳既不燃烧也不能支持燃烧且密度比空气大;因此验满二氧化碳气体的最简方法是:将燃着的木条放在集气瓶口,观察到木条熄灭.
故答案为:
(1)CaCO3+2HCl═CaCl2+H2O+CO2↑
(2)A
(3)氢气的密度比空气小;难溶于水且不与水反应
(4)将燃着的木条放在集气瓶口,观察到木条熄灭
点评:此题主要考查学生制取CO2和氧气的制取装置,CO2、氢气和氧气收集装置,反应原理及验满CO2气体的方法,熟悉各气体的性质,巩固培养学生的实验技能.
(2)实验室用高锰酸钾制取氧气,可选用的发生装置是 A,是合理的.原因是:凡是固体物质加热分解制取气体就可用此装置,实验室用的高锰酸钾是固体物质且需加热分解制氧气符合使用此装置.
(3)凡是密度比空气小且无毒的气体就可用向下排空气法,凡是难溶于水且不与水反应的气体就可用排水法收集;氢气的密度比空气小;难溶于水且不与水反应就可使用D或E装置.
(4)由于二氧化碳既不燃烧也不能支持燃烧且密度比空气大,所以验满二氧化碳气体的最简方法是:将燃着的木条放在集气瓶口,观察到木条熄灭.
解答:解:(1)实验室用B装置制取二氧化碳是合理的;原因是:凡是固体物质与液体反应且不需要加热就可用此装置.实验室制取二氧化碳用到固体大理石或石灰石与液体稀盐酸反应且不需要加热符合使用此装置,由于二氧化碳气体的密度比空气的大,可用C装置收集.因此正确书写制取二氧化碳气体的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)实验室用高锰酸钾制取氧气,选用发生装置 A 是合理的.原因是:凡是固体物质加热分解制取气体就可用此装置,实验室用的高锰酸钾是固体物质且需加热分解制氧气符合使用此装置.因此选用的发生装置是 A.
(3)凡是密度比空气小且无毒的气体就可用向下排空气法,凡是难溶于水且不与水反应的气体就可用排水法收集;氢气的密度比空气小;难溶于水且不与水反应就可使用D或E装置.因此此空应填:氢气的密度比空气小;难溶于水且不与水反应.
(4)由于二氧化碳既不燃烧也不能支持燃烧且密度比空气大;因此验满二氧化碳气体的最简方法是:将燃着的木条放在集气瓶口,观察到木条熄灭.
故答案为:
(1)CaCO3+2HCl═CaCl2+H2O+CO2↑
(2)A
(3)氢气的密度比空气小;难溶于水且不与水反应
(4)将燃着的木条放在集气瓶口,观察到木条熄灭
点评:此题主要考查学生制取CO2和氧气的制取装置,CO2、氢气和氧气收集装置,反应原理及验满CO2气体的方法,熟悉各气体的性质,巩固培养学生的实验技能.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
 锰酸钾+二氧化锰+氧气
锰酸钾+二氧化锰+氧气

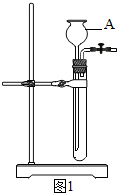 (2012?卢湾区一模)图-1是实验室制取二氧化碳气体的装置图,请回答下列问题:
(2012?卢湾区一模)图-1是实验室制取二氧化碳气体的装置图,请回答下列问题: