题目内容
50 g质量分数为38%的盐酸与足量大理石反应,生成二氧化碳多少克?这些二氧化碳的体积(标准状况)是多少升?(标准状况下,二氧化碳的密度为1.977 g/L)
解答过程分析:要明确“50 g”是谁的质量,在化学方程式计算中,涉及到的物质都应是纯物质,例如这个反应实质上是氯化氢与碳酸钙反应生成氯化钙、水和二氧化碳。而50 g指的是盐酸溶液的质量,所以不能直接代入化学方程式中进行计算,因为参加反应的是盐酸溶液中的溶质,所以应先求出其溶质质量:50 g×38%=19 g再根据方程式进行计算。
设生成二氧化碳的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
19 g x
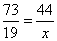 x=
x=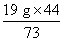 =11.45 g
=11.45 g
所以生成二氧化碳11.45 g
标准状况下二氧化碳的体积为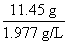 =5.8 L
=5.8 L

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某化学学习小组复习气体制取的实验原理与方法,内容如下:
(1)将课本的基础知识梳理归纳如下,请你共同完成相关内容:

(2)装置A的名称是
(3)对用氯酸钾和二氧化锰混合物制取O2后的固体残渣作如下回收处理:
①通过以下几步实验操作回收二氧化锰.正确操作的先后顺序是 (填写选项序号)
a.烘干,b.溶解,c.过滤
②用所得氯化钾晶体配制50 g质量分数为5%的氯化钾溶液,需要氯化钾的质量为 g.
③在过滤、蒸发时都需用到的仪器是 (填序号)
a.酒精灯,b.蒸发皿,c.玻璃棒,d.漏斗.
(1)将课本的基础知识梳理归纳如下,请你共同完成相关内容:

| 制取气体 | 装置连接顺序 | 反应的化学方程式 |
| 氧气 | ||
| 二氧化碳 | A接D | |
| Zn+H2SO4→ZnSO4+H2↑ |
(3)对用氯酸钾和二氧化锰混合物制取O2后的固体残渣作如下回收处理:
①通过以下几步实验操作回收二氧化锰.正确操作的先后顺序是
a.烘干,b.溶解,c.过滤
②用所得氯化钾晶体配制50 g质量分数为5%的氯化钾溶液,需要氯化钾的质量为
③在过滤、蒸发时都需用到的仪器是
a.酒精灯,b.蒸发皿,c.玻璃棒,d.漏斗.
