题目内容
常温下,在两个各盛有100 m L水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,结果如图所示。下列说法正确的是( )。
L水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,结果如图所示。下列说法正确的是( )。

A.甲溶液是不饱和溶液
B.常温下,甲、乙两种物质的溶解度相同
C.升高温度,剩余的甲固体一定能继续溶解
D.乙溶液可能是饱和溶液,也可能是不饱和溶液
D

练习册系列答案
相关题目
(1)下面是某化肥厂在一公共场所的围墙上做的广告:请仔细观察、分析,并回答下列问题:

①碳酸氢铵(化学式为:NH4HCO3)是由 种元素组成的.
②碳酸氢铵的氮含量是指氮元素的质量分数.根据所学化学知识,你认为此广告是 广告(填“真实”或“虚假”),判断的依据是
.
③碳酸氢铵受潮时在常温下就能分解,温度越高分解越快,因此保存时应注意: .
(2)某同学帮父亲去一家生产公司购买化肥,该公司化学售价表如下:
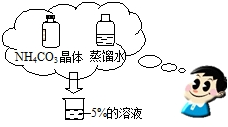
他知道自己的庄稼生长不茂盛、叶色淡绿、茎叶细小,也出现了倒伏现象.能供买化肥的钱只有300元,该同学稍作思考便选择购买了两个品种的化肥,而且花钱最少,购得所需的营养成分总的含量最多,试问: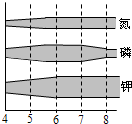
①该同学的庄稼缺两种营养成分,它们是 ;(填氮、磷、钾或微量元素)
②该同学买了碳铵化肥,则他买的另一种化肥是 .
(3)(4分)植物的生长需要营养元素,如图表示了土壤的pH和植物吸收这些元素的关系.栅栏越宽,营养元素的吸收率越高.
①当pH=4时,土壤显 性,在这种土壤中植物往往不能正常生长,这是因为
.
②如果施用一种能使作物根系发达、耐寒耐旱的肥料,当土壤的pH在 时,植物的吸收率较高.
(4)如果施用由硝酸铵和磷酸二氢铵组成的复合肥料,为了使营养元素能最大限度地被吸收,土壤的pH应该控制在 .
(5)碳酸氢铵[化学式NH4HCO3]可用作氮肥.在试管中加热碳酸氢铵能生成三种化合物,其中一种是氨气(化学式:NH3).请你根据所学知识.猜想另外两种生成物各是什么物质,并设计实验证明你的猜想(将有关内容填在下表中).
(6)请你参与某中学初三同学识别化肥的探究活动.他们从家中取来了五种化肥,分别是硫酸钾、氯化钾、碳酸氢铵、氯化铵和硝酸铵.
第一步:称取五种化肥各10g,分别研细.
第二步:取上述化肥各少量,分别加入少量熟石灰粉末,混合研磨,能嗅到气味的是三种铵盐.将下列硝酸铵和熟石灰反应的化学方程式填写完整:2NH4NO3+ ═ 2NH3↑+2H2O.
第三步:另取三种铵盐各少量,分别盛于三支试管中,均滴入少量盐酸,无明显现象的是氯化铵和硝酸铵,有气泡放出的是碳酸氢铵.反应的化学方程式:NH4HCO3+HCl═NH4Cl+ + .
第四步:另取氯化铵和硝酸铵两种铵盐进行识别,写出识别时发生反应的化学方程式: .
第五步:取两种钾盐,分别在试管中配成溶液,各滴入几滴氯化钡溶液,生成白色沉淀的钾盐是 ,无明显现象的钾盐是 .
查阅资料:物质的溶解性
(7)请根据如图要求,自编一道有关溶液的计算题,并进行解答.

①碳酸氢铵(化学式为:NH4HCO3)是由
②碳酸氢铵的氮含量是指氮元素的质量分数.根据所学化学知识,你认为此广告是
③碳酸氢铵受潮时在常温下就能分解,温度越高分解越快,因此保存时应注意:
(2)某同学帮父亲去一家生产公司购买化肥,该公司化学售价表如下:
| 肥料 | 尿素 | 硝铵 | 碳铵 | 过磷酸钙 | 硫酸钾 | 氯化钾 |
| 价格(元/吨) | 1200 | 1000 | 350 | 250 | 800 | 650 |

①该同学的庄稼缺两种营养成分,它们是
②该同学买了碳铵化肥,则他买的另一种化肥是
(3)(4分)植物的生长需要营养元素,如图表示了土壤的pH和植物吸收这些元素的关系.栅栏越宽,营养元素的吸收率越高.
①当pH=4时,土壤显
②如果施用一种能使作物根系发达、耐寒耐旱的肥料,当土壤的pH在
(4)如果施用由硝酸铵和磷酸二氢铵组成的复合肥料,为了使营养元素能最大限度地被吸收,土壤的pH应该控制在
(5)碳酸氢铵[化学式NH4HCO3]可用作氮肥.在试管中加热碳酸氢铵能生成三种化合物,其中一种是氨气(化学式:NH3).请你根据所学知识.猜想另外两种生成物各是什么物质,并设计实验证明你的猜想(将有关内容填在下表中).
| 猜想 | 实验操作 | 实验现象 | 结论 |
第一步:称取五种化肥各10g,分别研细.
第二步:取上述化肥各少量,分别加入少量熟石灰粉末,混合研磨,能嗅到气味的是三种铵盐.将下列硝酸铵和熟石灰反应的化学方程式填写完整:2NH4NO3+
第三步:另取三种铵盐各少量,分别盛于三支试管中,均滴入少量盐酸,无明显现象的是氯化铵和硝酸铵,有气泡放出的是碳酸氢铵.反应的化学方程式:NH4HCO3+HCl═NH4Cl+
第四步:另取氯化铵和硝酸铵两种铵盐进行识别,写出识别时发生反应的化学方程式:
第五步:取两种钾盐,分别在试管中配成溶液,各滴入几滴氯化钡溶液,生成白色沉淀的钾盐是
查阅资料:物质的溶解性
| 阴离子 阳离子 |
OH- | NO3- | Cl- | CO32-- | 备注: “-”表示遇水分解了 |
| NH+ | 溶、挥 | 溶 | 溶 | 溶 | |
| K+ | 溶 | 溶 | 溶 | 溶 | |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | |
| Ag+ | - | 溶 | 不溶 | 不溶 |

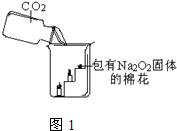 30、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.
30、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.

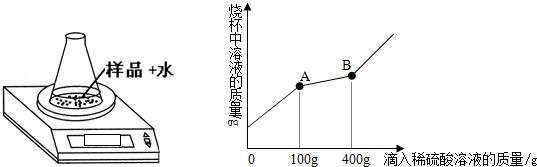
 下列是初三某合作学习小组实验室制取二氧化碳气体
下列是初三某合作学习小组实验室制取二氧化碳气体