题目内容
某化学兴趣小组,在变质的苛性钠中,加入一定量的稀盐酸,实验结束后,对所得“无色溶液”进一步探究.
【提出问题】反应后的溶液中含有哪些溶质呢?
【猜想与假设】甲同学猜想:溶液中只含有NaCl一种溶质; 乙同学猜想:溶液中含有NaOH、NaCl二种溶质;
【交流与表达】甲同学猜想的理由是(1)
【反思与评价】请对乙同学的猜想做出评价:(2)
甲同学为了验证自己的猜想,取少量烧杯中剩余的无色液体于试管中,加入了少量的氯化钙溶液,结果没有看到明显现象.请对甲同学的实验设计做出评价:(3)
【解释与结论】若通过实验证明甲同学的猜想是错误的,则无色溶液中溶质的化学式应该是(4)
【归纳与总结】在分析化学反应后溶液中溶质成分时,需要考虑的物质是(5)
CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2微溶,可能未溶解完;溶液从无色变白色.只能说明含CaCO3,不能证明只有CaCO3反应一定生成NaOH;固体中有Ca(OH)2,则溶液为Ca(OH)2的饱和溶液,Na2CO3.
【提出问题】反应后的溶液中含有哪些溶质呢?
【猜想与假设】甲同学猜想:溶液中只含有NaCl一种溶质; 乙同学猜想:溶液中含有NaOH、NaCl二种溶质;
【交流与表达】甲同学猜想的理由是(1)
氢氧化钠和碳酸钠跟稀盐酸恰好反应,都生成氯化钠
氢氧化钠和碳酸钠跟稀盐酸恰好反应,都生成氯化钠
【反思与评价】请对乙同学的猜想做出评价:(2)
乙同学猜想不正确.氢氧化钠存在碳酸钠也应存在
乙同学猜想不正确.氢氧化钠存在碳酸钠也应存在
甲同学为了验证自己的猜想,取少量烧杯中剩余的无色液体于试管中,加入了少量的氯化钙溶液,结果没有看到明显现象.请对甲同学的实验设计做出评价:(3)
甲同学设计不完整,此现象只能说明没有碳酸钠不能证明盐酸(HCl)是否存在
甲同学设计不完整,此现象只能说明没有碳酸钠不能证明盐酸(HCl)是否存在
【解释与结论】若通过实验证明甲同学的猜想是错误的,则无色溶液中溶质的化学式应该是(4)
NaCl、HCl
NaCl、HCl
【归纳与总结】在分析化学反应后溶液中溶质成分时,需要考虑的物质是(5)
生成的物质和剩余的反应物(可溶的物质)
生成的物质和剩余的反应物(可溶的物质)
CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2微溶,可能未溶解完;溶液从无色变白色.只能说明含CaCO3,不能证明只有CaCO3反应一定生成NaOH;固体中有Ca(OH)2,则溶液为Ca(OH)2的饱和溶液,Na2CO3.
分析:运用氢氧化钠、碳酸钠的化学性质解答该题,另外还要结合实验现象或结论解答.如:氢氧化钠和盐酸反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠、水、二氧化碳,故甲同学的猜想理由是氢氧化钠和碳酸钠跟稀盐酸恰好反应,都生成氯化钠.其余的类似.氢氧化钠存在碳酸钠也应存在(或盐酸应先跟氢氧化钠反应后与碳酸钠反应或即使盐酸先与碳酸钠反应生成二氧化碳,也会被氢氧化钠吸收,生成碳酸钠),故乙同学猜想不正确.
解答:解:氧化钠和盐酸反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠、水、二氧化碳,故(1)答案:甲同学的猜想理由是氢氧化钠和碳酸钠跟稀盐酸恰好反应,都生成氯化钠
(2)盐酸应先跟氢氧化钠反应后与碳酸钠反应或即使盐酸先与碳酸钠反应生成二氧化碳,也会被氢氧化钠吸收,生成碳酸钠,故(2)答案:乙同学猜想不正确.氢氧化钠存在碳酸钠也应存在(或盐酸应先跟氢氧化钠反应后与碳酸钠反应或即使盐酸先与碳酸钠反应生成二氧化碳,也会被氢氧化钠吸收,生成碳酸钠).
(3)从反应的物质的量的角度考虑,若盐酸有剩余则会含有氯化钠和氯化氢.故(3)和(4)得到答案.(3)答案:甲同学设计不完整,此现象只能说明没有碳酸钠不能证明盐酸(HCl)是否存在.
(4)答案:NaCl、HCl;
由以上的探究总结出(5)答案:生成的物质和剩余的反应物(可溶的物质).
故答案为:【交流与表达】(1)氢氧化钠和碳酸钠跟稀盐酸恰好反应,都生成氯化钠
【反思与评价】(2)乙同学猜想不正确.氢氧化钠存在碳酸钠也应存在
(3)甲同学设计不完整,此现象只能说明没有碳酸钠不能证明盐酸(HCl)是否存在
【解释与结论】(4)NaCl、HCl
【归纳与总结】(5)生成的物质和剩余的反应物(可溶的物质)
(2)盐酸应先跟氢氧化钠反应后与碳酸钠反应或即使盐酸先与碳酸钠反应生成二氧化碳,也会被氢氧化钠吸收,生成碳酸钠,故(2)答案:乙同学猜想不正确.氢氧化钠存在碳酸钠也应存在(或盐酸应先跟氢氧化钠反应后与碳酸钠反应或即使盐酸先与碳酸钠反应生成二氧化碳,也会被氢氧化钠吸收,生成碳酸钠).
(3)从反应的物质的量的角度考虑,若盐酸有剩余则会含有氯化钠和氯化氢.故(3)和(4)得到答案.(3)答案:甲同学设计不完整,此现象只能说明没有碳酸钠不能证明盐酸(HCl)是否存在.
(4)答案:NaCl、HCl;
由以上的探究总结出(5)答案:生成的物质和剩余的反应物(可溶的物质).
故答案为:【交流与表达】(1)氢氧化钠和碳酸钠跟稀盐酸恰好反应,都生成氯化钠
【反思与评价】(2)乙同学猜想不正确.氢氧化钠存在碳酸钠也应存在
(3)甲同学设计不完整,此现象只能说明没有碳酸钠不能证明盐酸(HCl)是否存在
【解释与结论】(4)NaCl、HCl
【归纳与总结】(5)生成的物质和剩余的反应物(可溶的物质)
点评:本题对探究实验分步进行了考查,必须全面分析实验中物质的反应情况,关键看谁有剩余.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
氢氧化钠是一种重要的化工原料.工业上常用电解饱和食盐水的方法来制取烧碱,并生成氯气(Cl2)和氢气.
(1)请写出工业上用电解饱和食盐水制取烧碱的化学方程式: .
(2)氢氧化钠溶液中滴入酚酞试液会变红色,氢氧化钠溶液中主要含有Na+、OHˉ、水分子.某探究小组为探究氢氧化钠溶液中的哪种微粒能使酚酞试液变红,设计了如下实验方案,得出了初步结论.
①请填写下表中的实验结论:
②是否需要做“向水中滴加酚酞试液”的对比实验?为什么?
(3)某化学兴趣小组同学在实验室用氢氧化钠与稀盐酸做探究实验.将两种溶液混合后,对溶液中溶质的可能组成作出如下猜想:
甲同学的猜想是:溶液中只有NaCl.
乙同学的猜想是:溶液中可能含有NaCl、NaOH、和 HCl.
①你认为甲乙两位同学的猜想都合理吗?并说明理由.
②请你提出一个与甲乙同学不同的猜想,并设计简单的实验证明你的猜想成立.
(4)有一瓶因保存不当而部分变质的氢氧化钠固体,为测其成分,称取10g样品配制成溶液,向其中滴加一定质量分数的稀盐酸,充分反应,共放出0.88g气体,试求样品中氢氧化钠的质量分数是多少?
(1)请写出工业上用电解饱和食盐水制取烧碱的化学方程式:
(2)氢氧化钠溶液中滴入酚酞试液会变红色,氢氧化钠溶液中主要含有Na+、OHˉ、水分子.某探究小组为探究氢氧化钠溶液中的哪种微粒能使酚酞试液变红,设计了如下实验方案,得出了初步结论.
①请填写下表中的实验结论:
| 实 验 过 程 | 实验现象 | 实 验 结 论 |
| 向盛有少量NaCl溶液的试管中滴入酚酞试液,振荡 | 溶液无明显 变化 |
(3)某化学兴趣小组同学在实验室用氢氧化钠与稀盐酸做探究实验.将两种溶液混合后,对溶液中溶质的可能组成作出如下猜想:
甲同学的猜想是:溶液中只有NaCl.
乙同学的猜想是:溶液中可能含有NaCl、NaOH、和 HCl.
①你认为甲乙两位同学的猜想都合理吗?并说明理由.
②请你提出一个与甲乙同学不同的猜想,并设计简单的实验证明你的猜想成立.
(4)有一瓶因保存不当而部分变质的氢氧化钠固体,为测其成分,称取10g样品配制成溶液,向其中滴加一定质量分数的稀盐酸,充分反应,共放出0.88g气体,试求样品中氢氧化钠的质量分数是多少?
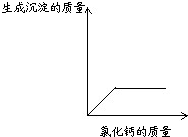 18、某化学兴趣小组,在学习碱的化学性质时,进行了如图所示的实验.
18、某化学兴趣小组,在学习碱的化学性质时,进行了如图所示的实验.

 17、已知M、N分别是稀盐酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH值,如图所示.
17、已知M、N分别是稀盐酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH值,如图所示. 已知M、N分别是稀硫酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示.
已知M、N分别是稀硫酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示.