题目内容
【题目】已知A~F均是初中化学常见的物质,它们属于不同类别的物质,相互关系如图所示。其中A的水溶液呈蓝色,常用于配制波尔多液,B是年产量最高的金属,D是无色无味的有毒气体,E是红棕色固体,F是一种难溶于水的碱,“→”表示转化关系,“-”表示相互之间能反应(部分反应物、生成物以及反应条件省略)。已知难溶于水的碱加热时分解为对应的金属氧化物和水,且反应中各种元素的化合价不变。请回答下列问题:
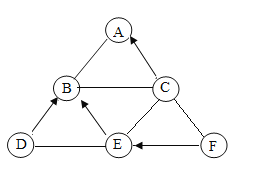
(1)A物质的类别属于____(选填酸、碱、盐或氧化物);F的颜色____,C和E的反应在生产、生活中的应用是_____;
(2)写出下列反应的化学方程式:D和E反应_________,C与F反应_________;
(3)一定量的B加入A的溶液中充分反应后,所得溶液的质量比A溶液的质量____(增加或减少);将所得溶液过滤,滤液中一定含有的金属离子名称______;
(4)上述变化中没有涉及的基本反应类型是______。
【答案】盐 红褐色 金属除锈 Fe2O3+3CO![]() 2Fe+3CO2 3H2SO4 +2Fe(OH)3=Fe2(SO4)3 + 6H2O 减少 亚铁离子 化合反应
2Fe+3CO2 3H2SO4 +2Fe(OH)3=Fe2(SO4)3 + 6H2O 减少 亚铁离子 化合反应
【解析】
A的水溶液呈蓝色,常用于配制波尔多液,则A是硫酸铜;B是年产量最高的金属,则B是铁;D是无色无味的有毒气体,则D是一氧化碳;E是红棕色固体能与一氧化碳反应,则E是氧化铁,F是一种难溶于水的碱,可以转化为氧化铁,则F是氢氧化铁;C能转化为硫酸铜,同时可以与铁、氧化铁、氢氧化铁三种物质反应,则C是硫酸;
(1)A是硫酸铜,由硫酸根和铜离子构成,物质的类别属于盐;F是氢氧化铁,颜色是红褐色,硫酸和氧化铁的反应在生产、生活中的应用是金属除锈;
(2):D和E反应:一氧化碳还原氧化铁:Fe2O3+3CO![]() 2Fe+3CO2,C与F反应:3H2SO4 +2Fe(OH)3=Fe2(SO4)3 + 6H2O;
2Fe+3CO2,C与F反应:3H2SO4 +2Fe(OH)3=Fe2(SO4)3 + 6H2O;
(3)一定量的铁加入硫酸铜的溶液中充分反应后,Fe+CuSO4=FeSO4+Cu所得溶液的质量比A溶液的质量减少;将所得溶液过滤,滤液中一定含有的金属离子名称亚铁离子;
(4)上述变化中:A-B反应Fe+CuSO4=FeSO4+Cu,符合“单质+化合物=新单质+新化合物”属于置换反应;C-F反应:3H2SO4 +2Fe(OH)3=Fe2(SO4)3 + 6H2O属于复分解反应;F→E反应:2Fe(OH)3![]() Fe2O3+3H2O,符合“一变多”属于分解反应;没有涉及的基本反应类型是:化合反应。
Fe2O3+3H2O,符合“一变多”属于分解反应;没有涉及的基本反应类型是:化合反应。

 口算题卡北京妇女儿童出版社系列答案
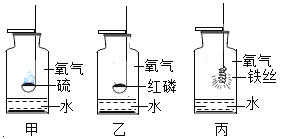
口算题卡北京妇女儿童出版社系列答案【题目】某同学发现一瓶没有塞上瓶塞的过氧化氢溶液,对该溶液中是否有过氧 化氢的剩余,与同学们一起进行如下探究实验。
(猜想与假设)猜想(1):该溶液中有过氧化氢的剩余。猜想(2):该溶液中没有过氧化氢的剩余。
(方案讨论)为了验证猜想,甲、乙、丙三同学分别提出如下方案:
甲:取适量试剂于试管中,伸入带火星的木条,若带火星的木条复燃,则猜想(1)成立,若带火星的木条不复燃,猜想(2)成立。
同学们认为此方案不行,原因是_____。
乙:取少量二氧化锰于试管中,加入与甲等量的试剂,若有气泡产生,则猜想(1)成立,若无气泡产生则猜想(2)成立,理由是___________________(写化学反应的符号表达式)
丙:
操作 | 现象 | 结论 |
取与甲同学等量的试剂于另一支试 管中,加热,再伸入带火星的木条 | ______________________________________, _______________________________________ | 猜想Ⅰ成立 |
(反思与交流)(1)敞口放置的试剂容易变质,所以要_____保存。
(2)二氧化锰在过氧化氢的分解过程中起_________作用。除此之外能改变化学反应速率的方法还可以_____