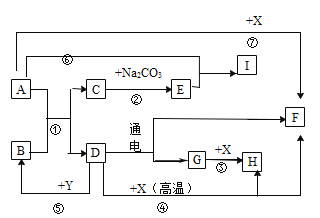
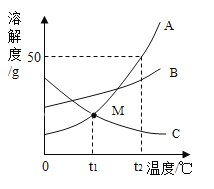
题目内容
【题目】某粗盐样品中含有杂质氯化镁、氯化钙,实验室提纯流程如下:
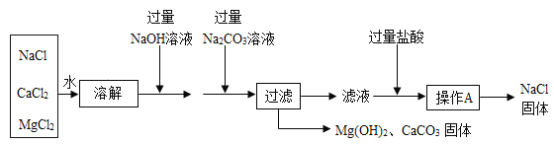
(1)操作A的名称为_____。
(2)在过滤操作中,除用到带铁圈的铁架台、烧杯、玻璃棒外,还需要用到的玻璃仪器是_____。
(3)加入过量氢氧化钠溶液目的是为了除尽粗盐中的_____。
(4)滤液中所含的溶质除含有氯化钠外,还含有_____。
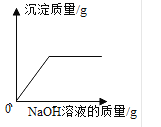
(5)若样品中含80gNaCl,理论上最终所得NaCl固体的质量_____80g(填“>”或“=”或“<”)。
【答案】蒸发 漏斗 氯化镁 氢氧化钠和碳酸钠 >
【解析】
(1)通过操作A,使溶液变为固态,故操作A是蒸发;
(2)在过滤操作中,用到的玻璃仪器是:烧杯、漏斗、玻璃棒;
(3)氢氧化钠能与氯化镁反应生成氢氧化镁沉淀,故加入过量氢氧化钠溶液目的是为了除尽粗盐中的氯化镁;
(4)加入过量氢氧化钠,氢氧化钠能与氯化镁反应生成氢氧化镁和氯化钠,加入过量碳酸钠,碳酸钠能与氯化钙反应生成碳酸钙和氯化钠,由于氢氧化钠、碳酸钠过量,故滤液中,除含有氯化钠外,还含有氢氧化钠和碳酸钠;
(5)氢氧化钠与氯化镁反应生成了氯化钠,氯化钙与碳酸钠也反应生成了氯化钠,氢氧化钠、碳酸钠与稀盐酸反应都生成了氯化钠,故理论上最终所得NaCl固体的质量>80g。

【题目】下列实验操作不能达到实验目的的是( )
实验目的 | 实验操作 | |
A | 除去碳粉中的铁粉 | 磁铁吸引 |
B | 除去CO中的少量CO2 | 通入足量的NaOH溶液 |
C | 除去CaO中的少量CaCO3 | 加足量的水,过滤 |
D | 除去NaOH溶液中少量Na2CO3 | 加适量的石灰水,过滤 |
A.AB.BC.CD.D
【题目】Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含 MgSO4和 H2SO4的混合溶液,为确定混合溶液中镁的含量,取 4 份混合溶液各 100g,向每份混合溶液中加入一定质量的 4% NaOH溶液,得到实验数据如下表所示:
实验编号 | ① | ② | ③ | ④ |
NaOH 溶液质量/g | 10.0 | 20.0 | 30.0 | 40.0 |
Mg(OH)2质量/g | 0.232 | 0.522 | 0.580 | 0.580 |
(1)实验 (填实验编号)中硫酸镁完全反应。
(2)计算 100g 混合溶液中含 MgSO4的质量(写出计算过程)