题目内容
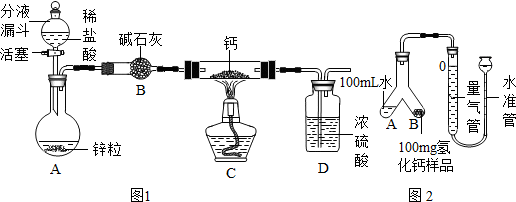
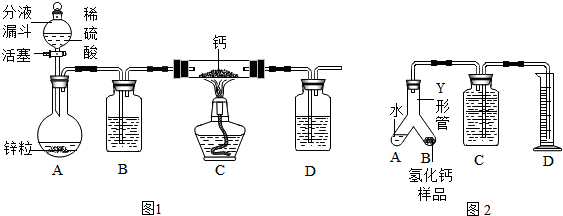
氢化钙(CaH2)固体是登山队员常用的能源提供剂.某化学兴趣小组拟用如图1所示的装置制备氢化钙,其反应的化学方程式为:Ca+H2 CaH2.
CaH2.
(1)CaH2中钙和氢元素的化合价分别为 ,装置中的无水氯化钙干燥装置也可用 来代替.
(2)利用该装置进行实验,步骤如下:检查装置的气密性后装入药品,打开分液漏斗活塞: (请按正确的顺序填入下列步骤的序号).
①加热反应一段时间 ②收集气体并检验其纯度 ③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)为了确认进入装置C的氢气已经干燥,应在B、C之间再连接一装置X,装置X中加入的试剂是 .若氢气未充分干燥,装置X中的现象为 .
(4)为了测量上述实验中制得的氢化钙的纯度,该小组称取mg所制得样品,按如图2所示装置进行测定.旋开分液漏斗活塞,反应结束后充分冷却,注射器活塞由反应前的V1mL刻度处变化到V2mL刻度处(V2<V1,气体密度为dg/mL)
①橡胶管的作用为:a. ;b. .
②旋开分液漏斗活塞后,除发生CaH2+H2O═Ca(OH)2+H2↑的反应外,还最有可能发生的反应为 .
③用w表示氢化钙的纯度,请用一个等式表示出d、V1、V2和w之间的关系 .
④该小组乙同学认为去掉连接的注射器,也要计算出氢化钙的纯度.他同样称取mg样品,加入烧瓶中后称取反应前的质量为m1g,反应后的质量为m2g.乙同学表示出的m,m1,m2和w之间的关系的等式为 .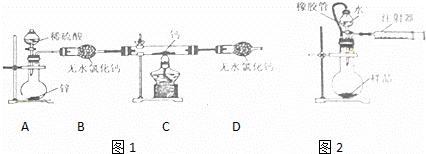
| (1)根据化合价原则和碱石灰的吸水性分析回答; (2)根据氢气是一种可燃性的气体与空气的混合气体在点燃时易发生要爆炸分析实验的操作顺序; (3)根据无水硫酸铜能与水结合生蓝色的硫酸铜晶体分析; (4)①根据橡胶管能将分液漏斗和烧杯联通分析作用; ②根据钙是较活泼的金属能与水反应分析; ③根据氢气的体积和密度求出氢气的质量,根据氢化钙与水反应的方程式,由氢气的质量,求出氢化钙的质量再求出氢化钙的纯度. ④根据质量守恒动装置减少的质量就是生成的氢气的质量,有上述计算可找出m,m1,m2和w之间的关系. | |
| 解答: | 解:(1)在CaH2中钙和氢元素的化合价分别为+2,﹣1,由于碱石灰有吸水性,装置中的无水氯化钙干燥装置也可用碱石灰来代替; (2)由于氢气是一种可燃性的气体与空气的混合气体在点燃时易发生要爆炸.所以,实验时,应打开分液漏斗活塞,使氢化钙与水反应生成氢气,收集氢气并检验其纯度,再通入一会儿排净装置中的空气,加热反应一段时间,等反应完成后停止加热,充分冷却.最后,关闭分液漏斗活塞.所以,正确的顺序是:②①④③; (3)由于无水硫酸铜能与水结合生蓝色的硫酸铜晶体.所以,为了确认进入装置C的氢气已经干燥,应在B、C之间再连接一装置X,装置X中加入的试剂是无水硫酸铜,若氢气未充分干燥,装置X中的现象为固体变蓝色; (4)①由于橡胶管能将分液漏斗和烧杯联通,所以起到的作用是:a.平衡分液漏斗和烧瓶中的气压;b.便于水流下; ②由于钙是较活泼的金属能与水反应,所以,可能发生的反应有:Ca+2H2O═Ca(OH)2+H2↑; ③氢气的质量为:(V2mL﹣V1mL)×dg/mL=(V2﹣V1)×dg 设氢化钙与水反应生成的氢气的质量为x CaH2+H2O═Ca(OH)2+H2↑ 42 2 mg×w x
设钙与水反应生成的氢气的质量为y Ca+2H2O═Ca(OH)2+H2↑; 40 2 mg(1﹣w) y
所以: ④由质量守恒定律可知,生成氢气的质量为:m1g﹣m2g 由上述计算可知: 所以: 故答为:(1)+2、﹣1,碱石灰;(2)②①④③;(3)无水硫酸铜,固体变蓝;(4)①a.平衡分液漏斗和烧瓶中的气压;b.便于水流下;②Ca+2H2O═Ca(OH)2+H2↑;③ |

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案 解得:x=
解得:x=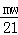 g
g 解得:y=
解得:y= g
g =m1﹣m2
=m1﹣m2 +
+