题目内容
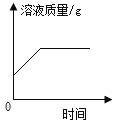
【题目】80g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的体积与加入的稀盐酸的质量关系如下图所示。试回答:
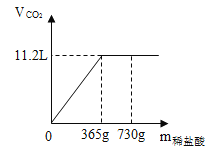
(1)该石灰石样品最多可以制取CO2___g;(结果取整数,CO2的密度为1.96g/L)
(2)该石灰石样品的纯度为多少?_____
(3)所用稀盐酸的浓度为多少?_____
【答案】22;62.5%;10%
【解析】
(1)二氧化碳的质量=1.96g/L×11.2L≈22g;
(2)设碳酸钙的质量为x,参加反应氯化氢的质量为y,

![]() x=50g,
x=50g,
![]() y=36.5g,
y=36.5g,
该石灰石样品中碳酸钙的质量分数是![]() ×100%=62.5%;
×100%=62.5%;
(3)所用稀盐酸的浓度![]() ×100%=10%,
×100%=10%,
答:(1)该石灰石样品最多可以制取CO222g;
(2)该石灰石样品的纯度为62.5%;
(3)所用稀盐酸的浓度为10%。

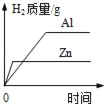
【题目】同学们在实验室发现了三种金属——铝、铁、铜,其中一块铜片生锈了,表面附有部分铜绿[铜绿的主要成分是Cu2(OH)2CO3],他们的实验探究过程如下:
(1)铜绿是铜与空气中的氧气、水和______(填化学式)共同作用的结果。
(2)为探究铝、铁、铜的活动性顺序,某同学设计了一组实验:①铝片浸入稀硫酸中;②铜片浸入稀硫酸中;③铝片浸入氯化亚铁溶液中,这组实验还不能完全证明三种金属的活动性顺序。请你补充一个实验来达到实验目的(写出化学方程式)______。
(3)他们用加热的方法除去铜绿,加热时却发现铜片表面全部变黑。经查阅资料知道:①铜绿受热分解会生成黑色的氧化铜 ②酒精在不完全燃烧时会生成炭黑 ③炭黑与稀硫酸不反应。
a、他们提出猜想:该黑色物质可能是氧化铜,也可能是氧化铜和_________的混合物。
b、设计了下述实验方案,用于检验黑色物质。
实验步骤 | 实验现象 | 结论 |
剪下一片变黑的铜片,放入盛有足量稀硫酸的试管中,微热 | 铜片表面黑色固体全部消失,露出红色的铜,溶液变______色。 | 此黑色固体是____(填化学式) |